- Címoldal
- Osztályok
- VII. osztály
- A 2020-as Kémiai Nobel díjmargójára ...
A 2020-as Kémiai Nobel díjmargójára Genomszerkesztés svájci bicskája: a CRISPR/Cas9 rendszer
Vellai Tibor (ELTE TTK, Genetikai Tanszék) és Perczel András (ELTE TTK, Szerves Kémiai Tanszék)
A francia Emmanuelle Charpentier (Patogén Tudományok Intézete, Berlin, Németország) és az amerikai Jennifer A. Doudna (Kalifornia Egyetem, Berkeley, USA) kutatók fele-fele arányban megosztva kapták a 2020. évi kémiai Nobel díjat. A Bizottság indoklása szerint a CRISPR/Cas9 genomszerkesztő rendszer kifejlesztésében végzett úttörő munkájukért nyerték el a világra szóló elismerést.
Az élővilágban az örökítő anyag univerzális formája a DNS (dezoxiribonukleinsav) molekula, amelynek szerkezeti egységei az egymáshoz kapcsolódó nukleotidok. A nukleotidok három részből épülnek fel, egy nitrogéntartalmú heterociklusból (adenin, guanin, timin vagy citozin), amelyet nukleobázisnak hívunk, egy pentóz molekularészből (dezoxiribóz) és egy foszfátcsoportból. A négyféle nukleotidot tehát a négy heteroaromás rendszer különbözteti meg egymástól, melyek egymás utáni sorrendje kódolja a genetikai információt. A haploid humán genom közel 3,1 milliárd nukleotidja 23 kromoszómába rendeződik. Minden egyes kromoszóma egyetlen összefüggő DNS molekula. A kromoszómák működési egységei a gének, amelyek végső termékei – a nem-kódoló RNS-ek és fehérjék – építik fel és működtetik sejtjeinket, valamint határozzák meg öröklődő tulajdonságainkat.
Az örökítő anyag megváltozása a gének és kódolt géntermékek szerkezeti és funkcionális megváltozásához vezethet. Már egyetlen nukleobázis cseréje egy másikra (pl. egy adenin helyett egy guanin épül be) azt eredményezheti, hogy egy normálistól eltérő aminosav épül be a kifejeződő fehérjébe, mely változás gyakran vezet humán patogén folyamatok kialakulásához. Például a p53 tumorszuppresszor fehérjében – amely feladata, hogy gátolja a sejtosztódását és elősegítse a kóros sejtek pusztulását – akár egyetlen kulcsfontosságú aminosav megváltozása rákos elváltozást okozhat. Megoldást jelenthetne, ha a mutáns p53 gén szerkezetében vissza lehetne állítani az eredeti nukleotidsorrendet, s ezáltal helyre tudnánk állítani a kódolt fehérje normális aminosavsorrendjét. Ezzel a beavatkozással a p53 fehérje visszanyerné eredeti funkcióit. De hogyan lehet egyetlen nukleotidot specifikusan kicserélni a genomban?
Nukleotid-szintű irányított DNS változtatásokra az elmúlt évtizedekben nem, vagy csak alig volt lehetőség, mivel a vizsgált génekben csak nagyrészt véletlenszerű változásokat tudtak a genetikusok indukálni. Egy mutálódott gén eredeti szerkezetének gyógyászati célú visszaállítására idáig csak nagyon korlátozott lehetőségek álltak a rendelkezésünkre. Ám a Charpentier és Doudna által kifejlesztett CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/CRISPR-associated nuclease 9 – rövid, fordított ismétlődésekkel elhatárolt szekvenciák genomi régiója/CRISPR-kapcsolt nukleáz 9) genomszerkesztő rendszer (alapító cikk: Jinek és mtsi., Science 337:816-821, 2012) éppen arra ad lehetőséget, hogy nukleotid-szinten lehessen a DNS-ben tárolt genetikai információt tetszőleges helyen, nagy hatékonysággal és pontosan módosítani. Ezért lett a CRISPR/Cas9 rendszer a genomszerkesztési technológiák precíziós svájci bicskája. A következő évtizedek tudományos fejlődéseit éppen ez a technológia, és az idetartozó alap- és orvosbiológiai kutatások és alkalmazások fogják döntően meghatározni. Úgy is fogalmazhatunk, hogy a CRISPR/Cas9 genomszerkesztő rendszer révén mind a genetika, mind a medicina lehetőségei kozmikus méreteket ölthetnek. E módszerben rejlő lehetőségek méltán vetekszenek a molekuláris biológia robbanás-szerű fejlődését lehetővé tevő PCR (polymerase chain reaction – polimeráz-láncreakció) technológia jelentőségével (Kary B. Mullis és Michael Smith, kémiai Nobel díj, 1993).
A CRISPR/Cas rendszer a baktériumok genomi immunválaszaként fejlődött ki az evolúció során. Leginkább a baktériumokat fertőző és bennük elszaporodó vírusok – az ún. fágok - elleni védekezés fő molekuláris fegyverzete. Amikor egy fág egy baktériumsejtet megfertőz, akkor a vírus bejutó genetikai anyaga átprogramozza a gazdasejt működését, és azt a vírus anyagainak szintézisére készteti. A folyamat eredményeként a gazdasejtben új vírusrészecskék szintetizálódnak, miközben a baktériumsejt gyakran elpusztul. Ám az a baktériumsejt, amelyik túlél egy ilyen fágfertőzést, képessé válik arra, hogy a fertőző vírus genomjának egy részletét a saját genomjába integrálja azért, hogy később „emlékezni tudjon” a fertőző ágens genetikai identitására. Ezzel a genomi memóriával egy újabb fertőzés során már felismeri a rosszindulatú betolakodót és védekezik vele szemben. Azt a genomi régiót a DNS-ben, ahová a baktériumsejt az idegen virális genomdarabot elraktározta, CRISPR szakasznak nevezzük. Ez a CRISPR rész tehát a baktérium evolúciós múltjában átélt fágfertőzések genomi lenyomatait őrzi egy-egy vírális genomrészlet formájában. A baktérium így képes különbséget tenni a „saját” és „idegen” (fertőzésként a sejtbe jutott) DNS szakaszok között. A CRISPR régió tehát rövid, ismétlődésekkel határolt, fág-eredetű DNS szakaszok együttese. Az újabb fertőzés elleni védekezés során a baktériumsejt a CRISPR genomszakaszról transzkripció révén úgynevezett pre-crispr RNS (pre-crRNS) átiratot készít. Ezek aztán feldarabolódnak, és az így keletkező rövid crispr RNS-ek (crRNS) nagymértékű szekvencia-specificitást mutatnak a fertőző fág egy genomi részletével. A baktériális genom egy másik része a CRISPR-hez kapcsolódó úgynevezett Cas régió, amely specifikus nukleázokat kódol. Ezek az enzimek képesek a duplaszálú DNS mindkét szálának elhasítására egy adott nukleotid mentén. A Cas fehérjéket egy másik RNS ágens, az ún. tracer (kereső) RNS (tracRNS) köti meg, és készíti elő a védekező harcra. A Cas fehérje-tracRNS komplexet és a crRNS-t egy további fehérje, nevezetesen az RNázIII enzim processzálja egy még nagyobb komplexbe, és alakítja át egy sikeres védekező fegyverzetté. Ebben a komplexben a tracRNS szállítja a DNS-t hasító Cas enzimet, amelyhez hozzákötődik a specificitást adó crRNS. A komplex éppen a megkötött a crRNS szekvenciája alapján ismeri fel a gazdasejtbe betolakodó fág DNS részeit, amelyet „azonosítás” után a Cas fehérje kettéhasít. A feldarabolt fág genom már nem tudja átprogramozni a gazdasejt működését, és ezért a gazdasejt túléli a fertőző támadást.
A több mint 1350 aminosavat tartalmazó Cas enzim hat különböző fehérje doménből épül fel, amelyek téralkata, önszerveződése és hatékony együttműködése gyors és pontos. A HNH és a RuvC nevű két nukleáz domén óramű pontossággal hasítja ketté a felismert idegen DNS-t. A komplex környezetbe ágyazott molekuláris „transzformer” működése szerves kémiai alapreakciók ismeretében könnyen megérthető. A DNS lánc hasítása nem más, mint egy polimer észter hidrolízise az evolúció során finomhangolt molekuláris környezetben. A molekuláris gépezet olajozottan működik, s a svájci bicska pontosan (megadott nukleotid mentén) hasít.
Fontos megemlíteni azt, hogy az eukarióta (sejtmagvas) élőlényekben is működik egy olyan genetikai apparátus, amely a baktériális CRISPR/Cas rendszerhez hasonló funkcióval bír. Az eukaróta sejteket szintén fertőzhetik virális patogének, amelyek DNS-e a gazdasejt magjába jutva beékelődhetnek egy adott genomi régióba. Onnan aztán képesek akár több ezer kópiában is lemásolódni és további genomi pozíciókba beékelődni. Az évmilliók során így alakultak ki a mobilis genetikai elemek (MGE-ek) vagy más néven az „ugráló gének”. Ilyen MGE-eredetű ismétlődő szekvenciák alkotják a humán genom több mint felét. Ezek a DNS darabok „ugrálásuk” során szinte bármilyen kromoszómarészbe képesek beugrani (integrálódni), és ezáltal inszerciós mutációkat hoznak létre, amelyek nagyfokú genomi instabilitást okoznak a befogadó DNS helyeken. Könnyen belátható, hogy az ugráló gének blokkolása kulcsfontosságú az élőlények hosszú távú fennmaradása érdekében. Minden egyes MGE típusból egy kópia az ún. piRNS genomi régióba kerül, és ez a szekvencia kijelöli az adott MGE-eket, amelyek géntermékét (hírvivő vagy „messenger” RNS; mRNS) egy fehérje elhasítja. A nem öregedő, korlátlan osztódási potenciállal rendelkező csíravonalban és a rákos szövetekben a MGE-ek hatékonyan gátoltak, biztosítva ezáltal e sejtek genetikai stabilitását. A bakteriális CRISPR és az eukarióta piRNS génszakaszok tehát egymás funkcionális analógjai. Mindkét rendszer kijelöli az „idegen” eredetű, vírusfertőzéssel bejutott genetikai elemeket, és közvetíti azok gátlását.
Charpentier és Doudna a Cas nukleázok ezen tulajdonságait (szekvencia-specifikus DNS hasítás) és a bennük rejlő biotechnológiai potenciált (nukleotid pontosságú genomszerkesztés) ismerték fel elsőként. Később a tracRNS-t és a crRNS-t fuzionáltatták, és egy ún. guide (irányító) RNS-t (gRNS) hoztak létre. A gRNS a tracRNS részével köti a Cas nukleázt, míg a crRNS részével kijelöli azt a genomi pozíciót, ahol a duplaszálú DNS hasításának meg kell történnie. Csupán egy 20 nukleotid hosszúságú gRNS szakasz már elegendő ahhoz, hogy akár a 3,1 milliárd nukleotid hosszúságú humán genomban egy specifikus felismerést, majd DNS vágást tegyen lehetővé. A kettősszálú DNS vágás azonban sejthalált okozna, ezért azt azonnal javítja a sejt DNS hibajavító gépezete. Éppen ebben rejlik a felfedezés igazi csodája. A kutató egy adott helyen belehasít a DNS-be, amely azonban ismét összeforr, és közben a „genomszerkesztést” is el lehet végezni. Ugyanis a CRISPR/Cas9-cel elhasított szabad DNS végek összeillesztésére két javítógépezet is rendelkezésre áll a sejten belül, amelyek egymással versengve javítják a DNS törést. Egyrészt a NHEJ (non-homologous end joining – nem homológ végek összeragasztása), másrészt a homológ rekombináció (HR) molekuláris apparátusa képes az elvágott DNS szálak „összeragasztására”. Az elhidrolizált észterkötés visszaalakítására van tehát két molekuláris rendszer - mondhatná a szerves kémikus. Az NHEJ egy gyors és hatékony, de nem pontos mechanizmus a szabad DNS végek összeillesztésére. A javítás során így gyakran képződnek inszerciós/deléciós hibák, néhány nukleotid ugyanis vagy kimarad, vagy éppen „feleslegbe” kerül a DNS javítás helyén. Így lehet mutáns génváltozatokat létrehozni a genetikai analízis számára. A HR-rendszer pontos javítást tesz lehetővé, de ehhez a javításhoz szükség van egy homológ DNS szakaszra (a homológ kromoszómáról vagy egy kívülről bejuttatott homológ DNS szakaszról), amelynek bemásolásával történik a DNS törés kijavítása. Ha a másolásra használt homológ templátban egy adott nukleotidot kicserélünk vagy egy riporter gént építünk be, akkor ezek bekerülhetnek a kívánt genomi régióba. Így lehet pl. egy mutáns nukleotidot normális nukleotidra kicserélni.
A DNS molekula irányított, tetszőlegesen kiválasztott nukleotidja mentén történő hasítás óriási lehetőségeket rejt magában. Elvileg bármely organizmus bármely génjében egy kiválasztott nukleotid mellett megtörténhet a DNS kettőszálú elvágása. A lézerkés pontosságú hasításhoz csupán egyetlen, specifikusan megszerkesztett gRNS és egy Cas9 nukleáz (2 komponens) előállítására van szükség (NHEJ-közvetített javítás). Ha viszont a javítást a HR-apparátus végzi el, akkor a hasítás helyére tetszőleges DNS szekvenciát lehet beépíteni egy megfelelően kiválasztott homológ (donor) DNS szakasz alkalmazásával. Ebben az esetben persze a Cas9-gRNS mellett a homológ DNS-szakaszt (3 komponens) is be kell juttatni a sejtbe. Ilyen módon lehet pl. riporter géneket beékelni egy kópiában endogén genomi környezetbe úgy, hogy célgén leolvasási kerete fennmaradjon. Ezzel bármely gén expressziós mintázata meghatározhatóvá válik, ha a megfelelő pozícióba beszerkesztünk egy riporter (pl. GFP) fehérje génjét. De HR-rel ki lehet cserélni a „rossz” (mutáns, betegséget okozó) nukleotidokat a laboratóriumban előzetesen megszintetizált „jó” szekvenciákra.
A patológiát okozó nukleotidok kicserélése „normális” szekvenciákra óriási orvosbiológiai jelentőséggel bír. Elméletileg így lehet egészséges sejtvonalakat és szöveteket létrehozni egy genetikai betegségben érintett egyénben, és ezzel az érintett test működését helyreállítani. Laboratóriumi körülmények között, állatmodellekben már eredményes kísérletek történtek pl. a cisztás fibrózis, az izomdisztrófia, az amiloid képződés vagy a szürkehályog genomszerkesztéssel történő terápiájára vonatkozóan.
Bár a CRISPR/Cas9 rendszer már ma is lélegzetelállítóan hatékony, de azért még messze nem tökéletes. Számos esetben a rendszer aspecifikus helyen, tehát nem a gRNS által kijelölt pontos cél DNS-szekvenciánál is hasít. Ezért a ma zajló fejlesztések főként ennek kiküszöbölésére irányulnak. Az örökletes genetikai betegségek megszüntetése vélhetőleg olyan pozitív fogadtatásra számíthat, mint amikor a 20. században felfedezett antibiotikumok és vakcinák következtében megszűnt számos tömeges megbetegedés. Miután azonban a nukleotid-pontosságú DNS szerkesztés elvileg már teljesen specifikus, és ezáltal biztonságos lesz, azután is számos kétely és etikai megfontolás fogja a módszer alkalmazását övezni. Mert mi lenne a jövőnkkel, ha DNS-ünket szabadon átszabhatnánk? Hibás gének kijavításával meggyógyíthatjuk ugyan öröklődő betegségeinket, de milyen hatással lenne ez az ökoszisztéma, a Föld egésze tekintetében? Azok a genetikai változtatások, amelyeket például a nem öregedő, tehát korlátlan osztódási potenciállal rendelkező csíravonal sejteken végeznének el, potenciálisan evolúciós távlatokban is velünk maradnának, s ezzel korábban sohasem látott módon és mértékben befolyásolnánk jövőnk alakulását. Bár a módszer lehetőségei korlátlannak tűnnek, de hol van az emberi beavatkozás természetes határa? Valóban szebb lesz ettől a jövőnk? Milyen lesz majd genomszerkesztett világunk az A. Huxley közismert "Szép új világ" című regényében olvasottakhoz képest?
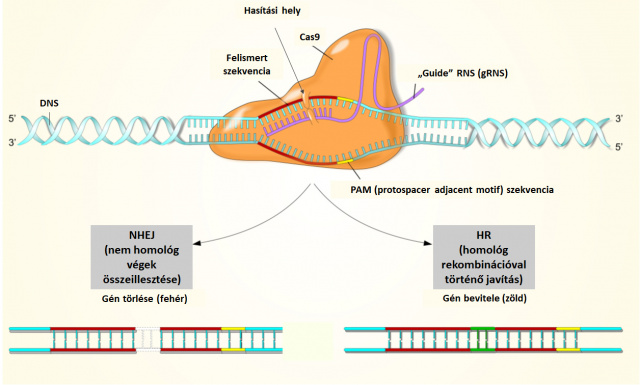
- Ábra. A CRISPR/Cas9 genomszerkesztő rendszer. A Cas9 nukleáz fehérje szekvencia-specifikus módon képes elhasítani a DNS két antiparallel szálát (duplaszálú DNS törést generál). A vágás helyét a gRNS („guide” vagy „vezető” RNS) jelöli ki. A gRNS-t a kutató szerkeszti meg, egyik része a szekvencia-specifikus felismerést, másik része a Cas9 kötést teszi lehetővé. A cél DNS szakaszon a vágás helyétől 3 bázispárra egy 3 bázispár hosszú ún. PAM (protospacer adjacent motif) szekvencia található, amely kell a hatékony vágáshoz. Az elvágott DNS szakaszt ki kell javítani (a szálakat össze kell forrasztani), különben a sejt elpusztul. A javítás kétféleképpen valósulhat meg. Egyrészt az elvágott DNS végek összeragasztásával (NHEJ – non-homologous en-joining), másrészt homológ rekombinációval (HR – homologous recombination). Az NHJE nem pontos javítást tesz lehetővé, sokszor maradhat ki néhány nukleotid vagy ékelődhetnek be felesleges nukleotidok. Az előző eset deléciós (fehér szekvencia az ábrán), az utóbbi eset inszerciós mutáns génváltozatokat eredményez. A HR pontos javítást tesz lehetővé. Ebben az esetben a javításhoz a mintát (templát) a homológ kromoszóma vagy a kutató által bejuttatott homológ DNS szakasz biztosítja. Ha a bejutatott DNS szakaszt előzetesen módosítják (pl. egy jó génváltozatot építenek be vagy egy riporter gént ékelnek be), akkor új gén(forma) (zöld szekvencia az ábrán) bevitelére van lehetőség.





