Mikroszkóp, molekuláris analitika és mesterséges intelligencia – szegedi kutatók komplex módszere segítheti a szövetek vizsgálatát
Szegedi kutatók az egysejt-analízis terén világviszonylatban úttörőnek számító megoldást dolgoztak ki, amely egyesíti a nagy teljesítményű mikroszkópia és a molekuláris analízis előnyeit. A több műszert összekapcsoló intelligens szoftverrendszernek köszönhetően az új eljárás minden eddiginél pontosabban képes a szövetbeli sejtsokaságból kiválasztani azokat az egyedi sejteket, amelyek meghatározóak a vizsgált szövet egészének viselkedése szempontjából. A megfelelő sejteket sértetlenül, a környező sejtek roncsolása nélkül emelik ki a mintából, és molekuláris analízissel elemzik. Eredményeiket a Nature Communications adta közre.
A szöveten belüli A cikk a Nature Communications oldalánsejtheterogenitás pontos leírása a daganatkutatástól a neurobiológiáig kiemelt jelentőségű, mert nélkülözhetetlen információt ad azokról az egyedi jellemzőkről, amelyek befolyásolják a szövet egészének biológiai viselkedését. Ezáltal segítheti az élettani mechanizmusok és a különféle kórfolyamatok jobb megismerését, és útmutatást adhat a gyógyszeres befolyásolhatóságra vonatkozóan, így kulcsfontosságú például a lehető leghatékonyabb, célzott terápia megválasztásához.
Szegedi kutatók az egysejt-analízis terén világviszonylatban úttörőnek számító megoldást dolgoztak ki, amely egyesíti a nagy teljesítményű mikroszkópia és a molekuláris analízis előnyeit. A mikroszkópokat és a molekuláris analízist végző berendezéseket összekapcsoló szoftverrendszer mesterséges intelligencia segítségével folyamatosan fejlődik, és minden eddiginél precízebben képes a szövetbeli sejtsokaságból kiválasztani azokat az egyedi sejteket, amelyek meghatározóak a vizsgált szövet egészének viselkedése szempontjából.
A környezetétől eltérő jegyeket hordozó vagy adott lokalizációjú sejt sértetlenül, a mikrokörnyezet roncsolása nélkül kiemelhető a mintából, majd az MTA Szegedi Biológiai Kutatóközpontjában (SZBK) és a Szegedi Tudományegyetemen rendelkezésre álló modern molekuláris vizsgálóeljárásokkal – köztük génszekvenálással, RNS-szekvenálással, digitális PCR-ral – részletesen analizálható. Ily módon feltérképezhetők azok a specifikus, sejtszintű adottságok, amelyek magyarázatot adnak például egy daganat biológiai viselkedésére, vagy megfelelő célpontjai lehetnek az egyénre szabott terápiának.
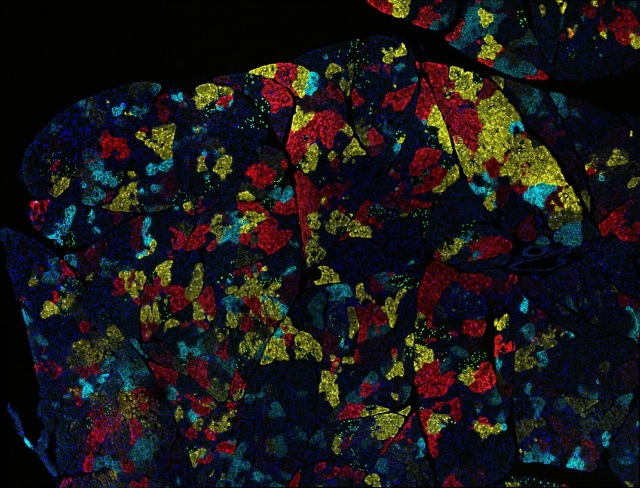 Egér hasnyálmirigytumor-sejtjei. Ebben a mesterséges modellben a színek különböző genetikájú tumorsejteket jelölnek (a kép a Pennsylvaniai Egyetem kutatójának munkája) Forrás: Flickr/NIH Image Gallery
Egér hasnyálmirigytumor-sejtjei. Ebben a mesterséges modellben a színek különböző genetikájú tumorsejteket jelölnek (a kép a Pennsylvaniai Egyetem kutatójának munkája) Forrás: Flickr/NIH Image GalleryLépésről lépésre
A sejttenyészetről vagy szövetmintáról egy automatizált, nagy áteresztőképességű mikroszkóp készít több ezer vagy akár millió felvételt, amelyeket egy képelemző szoftver dolgoz fel. A feldolgozás első lépése a képkorrekció, ami lehetővé teszi a minél pontosabb értékelést. Ennek alapján a program (Advanced Cell Classifier) az előzetesen definiált jellemzők figyelembevételével elemzi a képen kirajzolódó sejteket, és közben intelligens kérdésfeltevéssel kommunikál a biológussal vagy a patológussal. A kapott válaszokat beépíti saját tudástárába, így egyre növekvő pontossággal képes analizálni a rendelkezésre álló képadatokat.
Az elemzés eredménye egy CAMIO nevű interaktív online adatbázisba kerül, ahonnan a biológus/patológus a világ bármely pontjáról kiválaszthatja, mely sejteket érdemes a mintából izolálva tovább vizsgálni. A molekuláris elemzésre kijelölt egyetlen sejtet teljesen automatizált lézer-mikrodisszekcióval metszik ki. A mikrométeres mérettartománybeli precizitás azt jelenti, hogy a sejtet, melynek mérete a hajszál vastagságának tizedrésze, egy ennél is tízszer vékonyabb lézernyalábbal távolítják el a mintából. Ezt követi a szintén számítógéppel vezérelt molekuláris analízis.
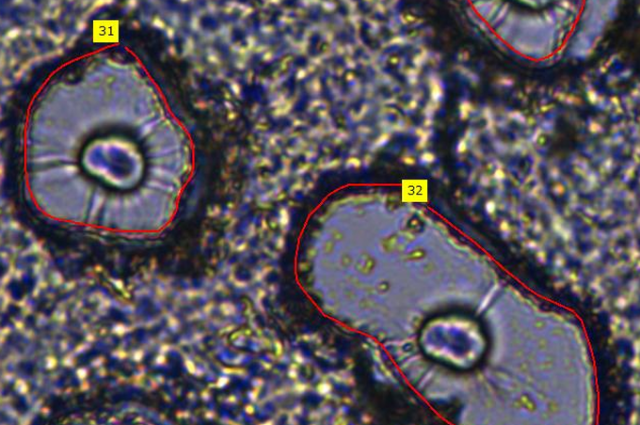 A rendszer által azonosított és körülhatárolt sejtek Forrás: MTA SZBK
A rendszer által azonosított és körülhatárolt sejtek Forrás: MTA SZBKMegbízhatóan teljesít
Az eljárás gyakorlati teljesítőképességét a kutatók több kísérletsorozattal igazolták olyan területeken, ahol a hagyományos sejtizolációs technikák nem alkalmazhatók. Agykérgi szövetmintákból sikerült nagy pontossággal kinyerniük meghatározott sejttípusokat úgy, hogy közben a környező sejteket nem károsították számottevő mértékben. A vizsgálatok igazolták, hogy a precíziós eljárással lehetséges a komplex szövetmintából egy-egy konkrét sejttípus egyetlen képviselőjét izolálni (pl. agykérgi szövetből piramissejteket, asztrocitákat), és az egyetlen sejtnyi mintát felsokszorozva a sejtbeli DNS-t és RNS-t részletes molekuláris elemzésnek alávetni. A szekvenálás pontos információt ad többek között a sejtre jellemző génexpressziós mintázatról.
Ennek egy további gyakorlati hasznosításaként igazolták, hogy a Szegeden kifejlesztett eljárás rendkívül érzékeny és költséghatékony alternatívája lehet a gének működésének vizsgálatára elterjedt RNS-interferencia módszerének. Csendesített géneket tartalmazó sejtvonalakat UV-fénnyel besugározva DNS-károsodást idéztek elő, ami egészséges sejtben azonnal beindítja a DNS-javító mechanizmusokat. A DNS-károsodás helye az odavándorló fehérjék fluoreszcens jelölésével jól láthatóvá tehető a mikroszkópos felvételeken.
Ha viszont a DNS-javító gének valamelyike hiányzik, a javítást végző (ún. repair) fehérjék nem dúsulnak fel a károsodott DNS-szakaszon, ennek alapján tehát elkülöníthetők a megfelelően működő és a DNS-károsodások javítása szempontjából diszfunkcionális sejtek. A kutatók az automatizált rendszerrel nagyszámú sejtet detektáltak, izoláltak és analizáltak mindkét típusból. A DNS-hibák javítását leghatékonyabban végző sejtek génállományának szekvenálásával számos ismert DNS-repair génről (BRCA2, RAD18, SPARTAN) igazolták, hogy valóban kulcsfontosságúak a DNS lánctöréseinek helyreállításában, de a módszer ennél többet is hozott: két további génről (RAD52, FANCA) is kimutatták, hogy szerepet játszhatnak a DNS-hibák kiküszöbölésének folyamatában.
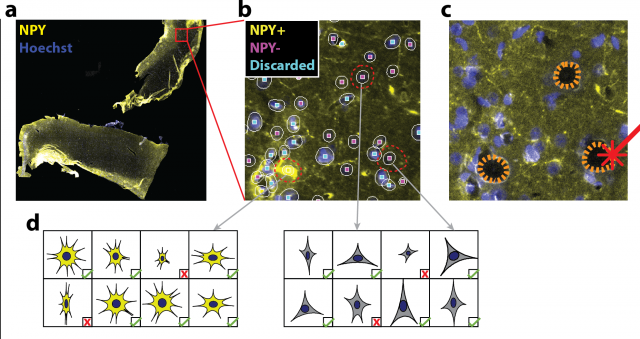 Az egysejt-analízis folyamata Forrás: MTA SZBK
Az egysejt-analízis folyamata Forrás: MTA SZBKIsmert technológia, új támogató környezet
A mikromanipuláció és a lézer-mikrodisszekció technikáját valójában közel két évtizede használják a patológiában/sejtbiológiában, a szegedi kutatók által kidolgozott automatizált, célzott és a mikrokörnyezet sértetlenségét megőrizve kivitelezett, nagy áteresztőképességű egysejt-izolálás azonban csak a jelenlegi fejlett számítógépes háttérrel vált megvalósíthatóvá. A számítógép vezérelte automatizálásnak köszönhetően nagyságrendekkel nőtt az egysejt-analízis pontossága és teljesítménye a hagyományos manuális sejtmanipulációval szemben. Azáltal, hogy az egyes vizsgálandó sejteket a patológus/biológus helyett a gépi tanulásra épülő algoritmus választja ki a szakember által megadott információk alapján, az emberi hibalehetőség is számottevően csökken.
Sőt, a komplex eljárás ennél többre is képes lehet: ha ugyanis a számítógép képes intelligensen kiválasztani egy sejtet, és a mintából kiemelve annak pontos jellemzését adja (például meg tudja nézni, hogy daganatos-e, milyen génhibákat hordoz stb.), az eredmények alapján ki tudja választani a következőt, majd a rá következőt, amelyeket a teljes sejtpopulációból vizsgálni érdemes.
A folyamat során a gép szisztematikusan tanítja magát, és olyan rejtett összefüggéseket is felfedezhet, amelyek adott esetben akár a biológus/patológus számára sem voltak ismertek. „Ezzel pedig potenciálisan eljuthatunk oda, hogy a szoftver a biológus/patológus prekoncepcióit kiküszöbölve teljesen objektív, új leírást ad az elemzett szövetről, újraírva eddigi ismereteinket számos betegség patomechanizmusáról” – mondta el Horváth Péter, az eljárás informatikai hátterét kidolgozó kutatócsoport vezetője. Ennek jegyében jelenleg két olyan nemzetközi kutatási projekt is zajlik – a Zürichi Egyetem Patológiai Intézetével, illetve a helsinki FIMM-mel (Finnish Institute for Molecular Medicine) együttműködésben –, amelyben betegségmodelleket validálnak az automatizált eljárás segítségével. A betegektől vett szövetmintából és a betegség laboratóriumi modelljeként szolgáló sejttenyészetből származó sejtek genetikai jellemzőit összevetve megállapítható, hogy a jelenleg használt sejtkultúrák jól modellezik-e a valós betegséget. A betegek szervezetéből származó minták genetikai jellemzőinek pontos leírása lehetőséget adhat olyan új szövetmodellek létrehozására, amelyek az adott betegség kórfejlődése szempontjából leginkább meghatározó sejtekből indulnak ki.
 Horváth Péter Forrás: MTA SZBK
Horváth Péter Forrás: MTA SZBKMultidiszciplináris együttműködés
A kollaborációs projekt informatikai hátterét Horváth Péter, az MTA SZBK Biokémiai Intézetének Szintetikus és Rendszerbiológiai Egységéhez tartozó Mikroszkópos Képfeldolgozó és Gépi Tanulási Csoport vezetőjének hazai és finnországi kutatócsoportjai dolgozták ki. A sokéves munka a kép-előfeldolgozástól a képfeldolgozás tökéletesítésén keresztül a mesterséges intelligenciára épülő algoritmusok megírásáig számos olyan lépcsőt magában foglal, amelyek nélkül nem lehetett volna eljutni az egyes sejtek ilyen szintű precizitást megvalósító elemzéséig. De nem kisebb a szerepe a kutatói team többi tagjának sem. Az agyszöveti minták vizsgálatát Tamás Gábor, a Szegedi Tudományegyetem Élettani, Szervezettani és Idegtudományi Tanszékének munkatársa, az MTA levelező tagja és kutatócsoportja, az izolált sejtek vizsgálatát Haracska Lajos, az MTA SZBK Genetikai Intézetének professzora, Puskás László, az MTA SZBK Funkcionális Genomika Laboratóriumának professzora és kutatócsoportjaik, valamint Nagy István, az SZBK Szekvenáló Platformjának tudományos munkatársa végezték.
További információ
Horváth Péter, MTA SZBK Biokémiai Intézet, Szintetikus és Rendszerbiológiai Egység, Mikroszkópos Képfeldolgozó és Gépi Tanulási Csoport
+3670 512 0015




