Kisebb szövet, kevesebb mutáció: sejtjeink újabb trükkje a rák ellen – Új eredmény az MTA Lendület programjában
A daganatok kialakulása a szervezeten belüli evolúciós folyamat. A gyorsan osztódó mutáns sejtek megzabolázásában azonban az immunrendszer mellett alapvető szerepe van annak is, hogy milyen hierarchia mentén alakulnak ki szöveteink sejtjei. E hierarchia egy új, hatékony védőfunkcióját fedezte fel az MTA-ELTE „Lendület” Evolúciós Genomika Kutatócsoportja.
A rákos megbetegedések a testi (szomatikus) sejtek körében lezajló evolúció eredményei, melynek során a testi sejtekben mutációk halmozódnak fel. A mutáció felhalmozódásának két fő oka van: először is, megújuló szöveteink (mint a bőrhám vagy a vér) életünk során nagyon nagy számú sejtet gyártanak le, ami sok sejtosztódást jelent. A mutációk fő forrásai pedig a sejtosztódás során lezajló DNS-másolási (replikációs) hibák.
Azonban nem minden mutáció egyforma: azok a mutáns sejtek, amelyek osztódási előnyt nyújtó mutációkat gyűjtenek össze, több utódsejtet hagynak hátra. Az utódsejtek mindegyike hordozza a mutációt. Ha egy sejtben több – jelen ismereteink szerint 3-5 db – osztódási előnyt nyújtó mutáció összegyűlik, utódai túlszaporodhatnak, ami rákos daganat kialakulásához vezet.
Biztonságra szövetkezve
Mivel a rákos daganat, különösen ha korán, még az utódnemzés előtt alakul ki, az egyed szintjén is szelekciós hátrányt jelent, feltételezhető, hogy az evolúció során olyan védekezési mechanizmusok alakultak ki szöveteinkben, amelyek a szomatikus evolúciót igyekeznek kordában tartani.
Korábbi eredmények azt mutatják, hogy a megújuló szövetek hierarchikus szerveződése kétféleképpen képes a szomatikus evolúció lassítására. Az egyik mechanizmus a mutáns sejteket folyamatos eltávolítása, ún. ,,kimosása” a hierarchia mentén történő differenciálódás segítségével.
Ezt a mechanizmust Martin Nowak és munkatársai (Nowak et al. 2003 PNAS) írták le először egy idealizált, lineárisan felépülő szöveti struktúrát feltételezve, melyben az egyes sejtek ,,libasorban” helyezkednek el egymás után. Egy adott sejt osztódásakor a sorban előtte álló sejtek eggyel eltolódnak, és a sor legelején álló sejt elhagyja a rendszert. Ebben a végletekig leegyszerűsített rendszerben csak akkor tud bent maradni egy mutáns sejt, ha a sor legelején található őssejtben alakul ki, minden más esetben „kimosódik” a rendszerből, hiszen idővel az őssejt kivételével mindegyik sejt „végigtolódik” a soron és elhagyja a szövetet.
Ideális hierarchia
Az MTA-ELTE „Lendület” Evolúciós Genomika kutatócsoport korábbi publikációjában Derényi Imre és Szöllősi Gergely (2017 Nature Communications) a hierarchikusan szerveződő szövetek egy második védekezési trükkjére derített fényt. Nowak és munkatársaival szemben egy általános, hierarchikusan szerveződő szövetet feltételeztek, melyben a hierarchia különböző szintjein álló sejtek különböző mértékben differenciáltak. A legalsó szinten az őssejtek, a köztes szinteken a progenitor sejtek, majd a hierarchia tetején a már osztódásra képtelen, terminálisan differenciált sejtek találhatóak. Derényi és Szöllősi megmutatta, hogy a ritkán differenciálódó őssejteken és fokozatosan egyre gyakrabban differenciálódó közbülső rétegeken alapuló hierarchikus szerveződés valóban olyan ideális megoldást jelent a megújuló szövetek fenntartására, amely az elvi minimum közelébe szorítja az osztódásokból származó mutációs terhelést.
Új szöveti trükk a rák ellen
A PNAS-ben most közzétett munkájukban az Evolúciós Genomika kutatócsoport tagjai, Grajzel Dániel fizikus doktorandusz és Szöllősi Gergely csoportvezető, valamint Derényi Imre, az ELTE TTK Biológiai Fizika Tanszék vezetője ezt az általános hierarchikus szövetmodellt fejlesztette tovább a sejtek közötti, a sejtszámot szabályozó kölcsönhatás figyelembevételével, amely révén a hierarchikus szöveteknek egy új, harmadik védekezési mechanizmusát tárták fel.
Grajzel és kollégai modellükben egy olyan, valódi szövetekben megfigyelhető szabályozást vezettek be a modelljükben, amely a sejtek osztódási ütemét lassítja vagy gyorsítja attól függően, hogy a kívántnál éppen több vagy kevesebb sejt van az adott kompartmentben. A ,,Lendület” kutatócsoport eredményeiből kiderül, hogy sejtszám-szabályozás jelenlétében a gyorsabban osztódó mutáns sejtek nem képesek megragadni a rendszerben, hacsak osztódási előnyük nem halad meg egy potenciálisan magas, a kompartmentmérettől függő küszöbértéket. Elegendően kis kompartmentméret esetén még a nagyon nagy előnyt biztosító mutációk is „kimosódnak” a rendszerből. A szomatikus evolúció és a rák kialakulásának szempontjából ez azt jelenti, hogy az osztódási előnyt nyújtó mutációkat hordozó sejtek csak rövid ideig vannak jelen a szövetben, így sokkal nehezebbé válik a daganat kialakulásához szükséges 3-5 mutáció összegyűlése egy sejtben.
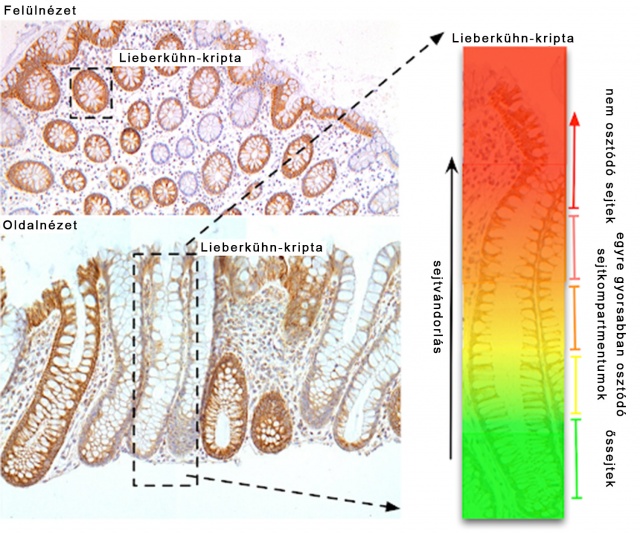 A vékony- és vastagbélben találhatóak az ún. Lieberkühn-kripták, a nyálkahártya betüremkedésszerű mirigyei. A Lieberkühn-kriptákat a bél hámrétegét alkotó sejtek folyamatos utánpótlását biztosítják. A bélhámsejtek fokozatosan egyre gyorsabban osztódó kompartmenteken keresztül vándorolnak a bélhám felszíne felé, ahol lelökődnek, így a bélcső hámrétege folyamatosan megújul. Ez a szerveződés, amely lehetővé teszi a sejtszám erős regulációját, a kutatás eredményei szerint a káros mutációk hatékony eltávolítására is alkalmas Forrás: Wikimedia Commons
A vékony- és vastagbélben találhatóak az ún. Lieberkühn-kripták, a nyálkahártya betüremkedésszerű mirigyei. A Lieberkühn-kriptákat a bél hámrétegét alkotó sejtek folyamatos utánpótlását biztosítják. A bélhámsejtek fokozatosan egyre gyorsabban osztódó kompartmenteken keresztül vándorolnak a bélhám felszíne felé, ahol lelökődnek, így a bélcső hámrétege folyamatosan megújul. Ez a szerveződés, amely lehetővé teszi a sejtszám erős regulációját, a kutatás eredményei szerint a káros mutációk hatékony eltávolítására is alkalmas Forrás: Wikimedia CommonsA kutatócsoport új eredményei nem pusztán elméletiek, hanem konkrét, kísérletileg ellenőrizhető jóslatokat is tesznek. Vegyük például az emberi vékony- és vastagbélben található ún. Lieberkühn-kriptákat, melyek körülbelül 500-700 sejtet tartalmaznak, a hierarchikus szintek számától függően egy kompartment mérete 60-600 sejt, és megbecsülhető a sejtszámfüggő reguláció erőssége. E a számok alapján az osztódási előnyre vonatkozó küszöbérték 10% és 50% közé esik, ami egybecseng az ismert osztódási előnyt adó mutáció mért magas értékekkel (Vermeulen et al 2013 Science). Egyéb szöveteknél jelenleg nem áll rendelkezésre elegendő ismeret a hasonló összehasonlításhoz, de a legújabb DNS-szekvenálási adatok az mutatják, hogy a normál premalignens szövetben hosszabb távon fennmaradó mutációk nagymértékű osztódási előnnyel bírnak (Martincorena et al 2018 Science).
Fiatalság, Lendület
Grajzel Dániel negyedik féléves fizika BSc hallgatóként csatlakozott MTA-ELTE „Lendület” Evolúciós Genomika kutatócsoporthoz, mely a megújuló szövetek dinamikájával és a rák kialakulásával foglalkozik. ,,Akkoriban fogalmam sem volt arról, hogy mit jelent igazából (bio)fizikusnak lenni, mit jelent az, ha valaki kutató. A közös munka során egyre jobban beletanultam a kutatásba, fokozatosan nőttek a feladatok és elvárások, velük párhuzamosan az eredmények is. Nagy élmény volt például MSc hallgatóként a természettudományi kari TDK-ra készített munkám eredményeiről előadást tartani egy USA-beli nemzetközi konferencián” – mondta Grajzel Dániel.
A kutatócsoport vezetője, Szöllősi Gergely János kutatói pályafutásában a Lendület program kétszeresen is fontos szerepet játszott. Mint mondta, „a Lendület program miatt tudtam hazajönni és Lendület program tartott itthon. 2013-ban ugyanis Derényi Imre MTA-ELTE »Lendület« Elméleti Biofizika kutatócsoportja adott lehetőséget, hogy hazajöjjek franciaországi posztdoktori kutatásaim után. 2016-ban pedig a lehetőség, hogy saját Lendület-csoportot alakítsak, volt az, ami miatt itthon maradtam. A Lendület program nélkül éppen Münchenben vagy Lyonban folytatnám kutatásaimat Budapest helyett.”