Forradalmi változást hozott a biológiában a Nobel-díjjal elismert új mikroszkóp
A krio-elektronmikroszkópia kifejlesztéséért kapta az idei kémiai Nobel-díjat megosztva három kutató, Jacques Dubochet, Joachim Frank és Richard Henderson. A szerkezeti biológia lehetőségeit kibővítő eszköz létrejöttéig vezető út fontosabb állomásait Závodszky Péter akadémikus foglalta össze az mta.hu számára.
A krio-elektronmikroszkópia kifejlesztése az utóbbi évtized legjelentősebb technikai eredménye a tudományban. Különlegessége abban rejlik, hogy a mintákat fixálás vagy bármiféle festés nélkül, saját természetes vizes környezetükben teszi megfigyelhetővé elektronmikroszkópos úton, és nagy felbontású, 3 dimenziós szerkezeti képet eredményez.
Ennek a biológiában rendkívüli jelentősége van.
A hagyományos elektronmikroszkópokkal ugyanis a biológiai szerkezeteket természetes vizes környezetükben, natív, funkcionális állapotukban nem lehetett ilyen eszközzel tanulmányozni. Ennek oka a mintakészítés módja és a képalkotáshoz használt, nagy intenzitású elektronnyaláb roncsoló hatása.
 Jacques Dubochet, Joachim Frank és Richard Henderson Fotó: AP, Columbia University Medical College, MRC Laboratory of Molecular Biology
Jacques Dubochet, Joachim Frank és Richard Henderson Fotó: AP, Columbia University Medical College, MRC Laboratory of Molecular BiologyA most Nobel-díjjal értékelt fejlesztés két területen hozott forradalmi újítást. Egyrészt megoldotta a hidratált, natív állapotú szerkezetet megőrző mintakészítés problémáját a gyorsfagyasztás technikájának kidolgozásával. Másrészt a számítógépes képalkotás fejlesztésével lehetővé tette az alkalmazott elektronnyaláb intenzitásának, így szerkezetroncsoló hatásának jelentős csökkentését a képminőség és a felbontás megőrzése mellett.
Évtizedek munkája
Hosszú út vezetett az idei Nobel-díjig. Az élettudományokban régen megjelent az igény a nagy felbontású szerkezeti képalkotásra. A technikai fejlődés az ötvenes években lehetővé tette a röntgendiffrakciós technika alkalmazásával kristályosítható biológiai makromolekulák szerkezetének meghatározását, atomi szintű felbontással. Ezzel a módszerrel számos fehérje szerkezetéről nyertünk statikus képet. A nyolcvanas években jutott el a mag-mágnesesrezonancia (NMR) a fejlődésnek arra a fokára, hogy segítségével fehérjeméretű makromolekulákról nyerhettünk dinamikus képet. Ez jelentős lépés volt abba az irányba, hogy a szerkezet és funkció közvetlen kapcsolata megérthető legyen a maga dinamikus voltában.
Vannak azonban olyan biológiai szerkezetek, amelyek nem kristályosíthatóak, s méretük vagy oldhatatlanságuk folytán NMR-rel sem vizsgálhatóak (pl. membránfehérjék, csatornák, sejtorganellumok). Ezekben az esetekben jelentkezett az elektronmikroszkóp használatának igénye, amit azonban a fent említett technikai problémák gátoltak. Szerencsénkre voltak céltudatos és kitartó kutatók, akik megfogalmazták a célt, és évtizedeken át kitartóan dolgoztak a mások által reménytelennek ítélt problémán.
Három hely, három szál
A most beérett munka a hetvenes években kezdődött, és három helyen, három szálon futott mindaddig, amíg végül a krio-elektronmikroszkópia technikájában egyesült a 2010-es években.
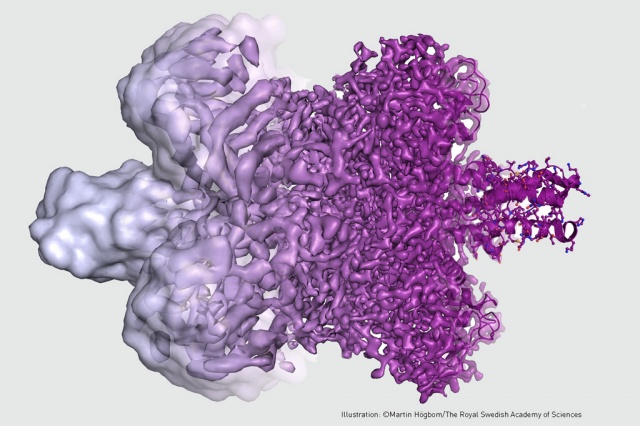 Fehérjemolekula – ahogyan 2013 előtt látták, és ahogyan az atomi szintű képfelbontás elérése után láthatják a kutatók Forrás: Martin Högbom/The Royal Swedish Academy of Science
Fehérjemolekula – ahogyan 2013 előtt látták, és ahogyan az atomi szintű képfelbontás elérése után láthatják a kutatók Forrás: Martin Högbom/The Royal Swedish Academy of ScienceA mai krio-elektronmikroszkóp létrejöttének első lépése a remény felkeltése volt 1990-ben, amikor Cambridge-ben, az MRC Molekuláris Biológiai Laboratóriumában Richard Henderson és munkatársai egy membránba ágyazott, bonyolult fehérje, a bakterio-rodopszin szerkezetét határozták meg nagy felbontással, elektronmikroszkóppal.
Kiderült, hogy az eddig reménytelennek ítélt út járható.
Ez az eredmény lehetővé tette a képfeldolgozás és az elektronmikroszkópos technika tökéletesítését is.
Ezzel párhuzamosan, de ettől függetlenül, a heidelbergi Európai Molekuláris Biológiai Laboratóriumban egy Svájcból érkezett fiatalember, Jacques Dubochet már két évtizede dolgozott nagy elszántsággal azon, hogy elektronmikroszkópos vizsgálatra alkalmas biológiai mintakészítési eljárást fejlesszen ki. Az általa kidolgozott gyorsfagyasztási eljárás lehetővé teszi, hogy vizes közegben lévő biológiai mintákat készíthessünk. Egy fémkereten kialakított szénrácson sikerült – rutinszerűen – mikrométer vastagságú réteget képezni a vizes mintából, amelyet ezután –190°C hőmérsékletű etánfürdőbe belőve, nagy sebességgel megfagyasztottak. A gyors fagyasztás nem teszi lehetővé apró – az elektronsugárzást károsan szóró, képminőséget rontó – jégkristályok kialakulását, a víz strukturálatlan, amorf formában szilárdul meg, vitrifikálódik, és ez megakadályozza a vákuumban való párolgást is. Az így készített mintában a biológiai objektum (vírus, membráncsatorna, fehérjekomplex, bakteriofág, DNS) megőrzi hidratált, natív szerkezetét. Mintegy befagyasztható működésének egy bizonyos időpontjában, a maga természetes állapotában. Ez a minta egy olyan oldatfilm, ami elég vékony ahhoz, hogy gyorsan lehűthető legyen, ugyanakkor elég vastag ahhoz, hogy befogadjon egy molekuláris réteget a vizsgálandó, véletlenszerűen orientált molekulákból vagy komplexekből.
A mintakészítés problémája így megoldódott, a minta natív állapotának megőrzése sikerült, azonban a megfelelő képélesség elérése érdekében az elektronsugár intenzitásának csökkentésére is szükség volt.
Miközben ezek a próbálkozások folytak, a technika is fejlődött: jelentősen javult az elektrondetektorok érzékenysége, és fejlődtek a számítógépes képelemző eljárások is.
A harmadik szálat a New York-i Columbia Egyetem jelentette. Ott dolgozott a hetvenes évektől Joachim Frank biofizikus. Célja a nem kristályos, aszimmetrikus, véletlenszerűen orientált, oldott molekulák (ilyenek a fagyasztott biológiai szerkezetek) „elmosódott” szórási képeinek számítógépes, matematikai analízise és „feljavítása” volt, s erőfeszítéseit siker koronázta. Munkatársaival nagyszámú szórási kép automatikus kiválogatásának, értékelésének és analízisének problémáját oldotta meg, és összegezte a mások által is egyszerűen használható SPIDER programcsomagban.
E módszer segítségével nagyszámú kis felbontású képből nagy felbontású háromdimenziós képet kaphatunk.
Új korszak kezdődött
Sok kiváló és elkötelezett kutató több évtizedes munkájából így összeállt egy korábban nem remélt, nagyszerű technikai eszköz, a krio-elektronmikrószkóp, amely új lehetőséget nyit meg a szerkezeti biológia előtt. Lehetővé teszi, hogy komplex makromolekuláris rendszereket működésük egy pillanatában, natív állapotban befagyasszunk, és atomi szinten határozzuk meg szerkezetüket, topográfiájukat, kölcsönhatásaikat.
Egy új eszköz megjelenése mindig felszínre hoz olyan kérdéseket, amelyeket – a technika hiányában – korábban fel sem vetettek. Új korszak kezdődött ezáltal a szerkezeti alapon nyugvó funkcionális biológia előtt. Így volt ez korábban a fehérje-röntgenkrisztallográfia, majd a biológiai NMR bevezetésekor, s valószínűleg most sem lesz másképp.





