Szegedi sejtvizsgálatok igazolták cambridge-i kutatók új fehérje-biokémiai elméletét
Az MTA Szegedi Biológiai Kutatóközpont kutatóinak segítségével igazolta egy prominens nemzetközi kutatóhálózat, hogy miként befolyásolja a fehérje-térszerkezet kialakulását a szintetizálódó fehérjealegységek felépítése. A kutatás során gépi tanulásra képes elemző algoritmussal vizsgáltak több mint 600 ezer sejtről készült mikroszkópfelvételt.
Magyar kutatók az MTA Szegedi Biológiai Kutatóközpontban (MTA SZBK) rendelkezésre álló, speciális informatikai háttérrel összekapcsolt mikroszkóprendszer segítségével járultak hozzá egy elmélet igazolásához, amely a fehérjekomplexek szintézise közben fellépő kóros sejtfolyamatokat magyarázza. A fehérjék egy része nagyobb komplexekbe szerveződve látja el feladatát. Az elmélet szerint azonban, ha az azonos alegységekből álló fehérjekomplexek túl korán kapcsolódnak össze a fehérjeszintézis során, akkor
a sejtekre káros, úgynevezett fehérjeaggregációs folyamat játszódik le.
A kutatók kimutatták, hogy a funkcionális térszerkezet kialakulásának sikerét alapvetően meghatározza, hogy a fehérjekomplex alegységeinek összekapcsolódásáért felelős régió a fehérjemolekulán belül hol helyezkedik el. Attól függően, hogy e specifikus terület az aminosavlánc elején vagy végén található, kisebb vagy nagyobb eséllyel jön létre működőképes vagy funkcióképtelen óriásmolekula. A fehérjekutatás egy új irányát jelentő in vivo vizsgálatsorozat új utakat nyithat a kóros fehérjeszintézissel összefüggő betegségek befolyásolásában.
Véletlenek sikeres összjátéka
Éppúgy, ahogy a sejten belüli molekuláris folyamatokban kulcsszerepet játszanak a mikrokörnyezeti adottságok, a kutatói együttműködést is egy szerencsés tudományos találkozás hozta. A szegedi projektrészt vezető Kintses Bálint, az MTA SZBK Szintetikus és Rendszerbiológiai Egységéhez tartozó Kísérleti Evolúcióbiológiai Csoport kutatója egy konferencián ismerkedett meg Sarah A. Teichmann-nal, a brit Wellcome Trust Sanger Institute genetikai intézetének igazgatójával, aki egyike a legelismertebb szaktekintélyeknek a fehérje- és genomkutatás terén.
A közös kutatói érdeklődés rövidesen közös munkát hozott: kiderült, hogy a nemzetközi kutatóközösség számára egyedülálló lehetőséget nyújtana a Szegeden kifejlesztett sejtvizsgálati módszer. A prominens cambridge-i és oxfordi kutatókkal elindult kooperáció keretében az MTA SZBK-ban, a Horváth Péter által létrehozott, teljesen automatizált mikroszkóprendszeren, Pál Csaba, Papp Balázs és Magyar Zoltán csoportjaival karöltve, végeztek genomszintű hatásvizsgálatokat. A közös kutatómunka mára jelentős eredményeket hozott – legfrissebb eredményeiket a szerkezeti biokémiai folyóirat, a Nature Structural and Molecular Biology közölte (a cikk ide kattintva érhető el).
A kiindulási elmélet
A fehérje-térszerkezet kialakulását befolyásoló tényezők jobb megismerését célzó kutatás egy ma még viszonylag kevéssé tisztázott terület, a szintézis közbeni feltekeredés (kotranszlációs folding) és a kóros aggergáció viszonyát volt hivatott jellemezni, in vivo körülmények között. A kutatást vezető brit tudósok hipotézise az volt, hogy az azonos alegységekből (homooligomerekből) felépülő fehérjekomplexek esetében nagyobb az esélye a hibás feltekeredésnek, ha az egyes alegységek összekapcsolódását biztosító molekularészlet – azaz a negyedleges térszerkezet kialakításáért felelős, ún. interakciós felszín – a fehérje N-terminális végén (vagyis a molekula „elején”) helyezkedik el, szemben azzal, ha a C-terminális véghez (azaz a fehérjemolekula „végéhez”) esik közel. Az előbbi esetben ugyanis már azelőtt megkezdődhet az alegységek összekapcsolódása, hogy a teljes fehérjealegység szintézise befejeződne, ez pedig növeli a hibás összeépülés esélyét, ami funkcióképtelen fehérjeaggregátumot eredményez.
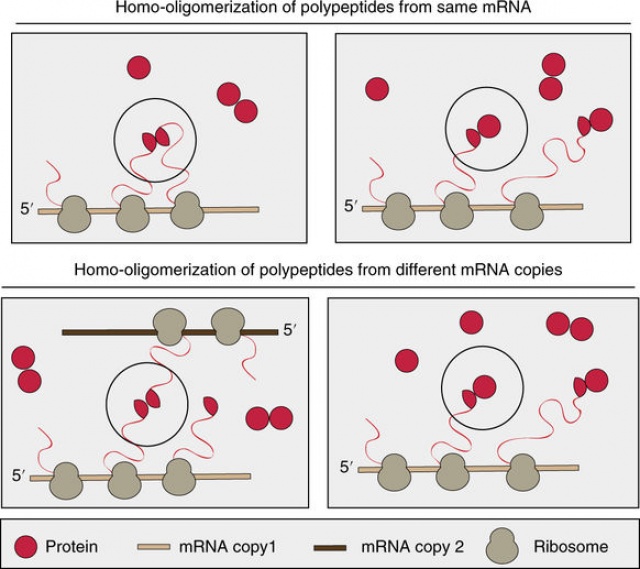 Ilyen módokon tekeredhetnek fel szintézis közben az azonos alegységekből (homooligomerekből) felépülő fehérjekomplexek Forrás: Nature Structural and Molecular Biology/Eviatar Natan et al.
Ilyen módokon tekeredhetnek fel szintézis közben az azonos alegységekből (homooligomerekből) felépülő fehérjekomplexek Forrás: Nature Structural and Molecular Biology/Eviatar Natan et al.A hipotézis igazolásának előkészítéseként a kutatók egy fehérjeadatbank nagy léptékű elemzésével nyertek információt a kapcsolódási felszín molekulán belüli lokalizációjáról és egyéb szerkezeti jellemzőiről. E vizsgálat nagyszámú organizmusra vonatkozóan igazolta, hogy az ismert szerkezetű homomereknél jellemzően a fehérjemolekula C-terminális végéhez esik közelebb a negyedleges térszerkezet kialakulását biztosító kapcsolódási domén.
A kapcsolódási felszín lokalizációja és a térszerkezet kialakulása közötti kapcsolat igazolására az Escherichia coli baktériumot használták modellorganizmusként, mégpedig olyan variánsát, amelyben a baktériumsejtben termelődő 611-féle homooligomer fehérjét fluoreszcens molekulával (GFP) jelölték. A homooligomerek mindegyikét egyesével túltermelődésre (overexpresszió) késztették, majd kísérletenként mintegy 1000 egyedi sejt vizsgálatával elemezték, hogy rendben ment-e végbe az egyes homooligomer típusú fehérjék szintézise. A proteinszintézis megfelelő vagy kóros voltára a fluoreszcencia méréséből következtettek: ha a negyedleges térszerkezet kialakulása túl korán (vagyis már a harmadlagos térszerkezet felvétele előtt) megkezdődött, és a fehérje emiatt aggregálódott, akkor a fluoreszcens molekularészlet szintézise elmaradt, így a mikroszkópos képen a sejt sötéten rajzolódott ki. Ha viszont nem történt zavar a folyamatban, akkor a megfelelő térszerkezetű fehérjemolekulán a fluoreszcens részlet is rendben kialakult, ezek a sejtek tehát zölden fluoreszkáltak a mikroszkópos felvételeken.
A nagy áteresztőképességű mikroszkópiával Horváth Péter és kollégái több mint 600 ezer sejtet vizsgáltak meg. E kimagaslóan nagyszámú mikroszkópos kép alapján a gépi tanulásra (mesterséges intelligenciára) épülő képelemző algoritmus minden egyes sejtről képes volt eldönteni, hogy a felsokszorozott homooligomer fehérje térszerkezete megfelelt-e a normálisnak, vagy sem. A térszerkezeti adatokkal való összevetést követően azt találták, hogy a mikroszkópban megfigyelt kóros folyamat függött attól, hogy az adott fehérjén hol helyezkedik el az interakciós felszín. A fehérjemolekula végéhez közelebb eső kapcsolódási felszínekkel rendelkező fehérjék esetében nagyságrendileg nagyobb fluoreszcens szignált észleltek a kutatók, ami vizsgálatukban a megfelelő térszerkezet kialakulásának jele volt. Az eredmények igazolták, hogy a kiindulási hipotézis helyes, és valóban nagyobb eséllyel sérül a térszerkezet akkor, ha az alegység-összekapcsolódási felszín a fehérje elejéhez esik közelebb.
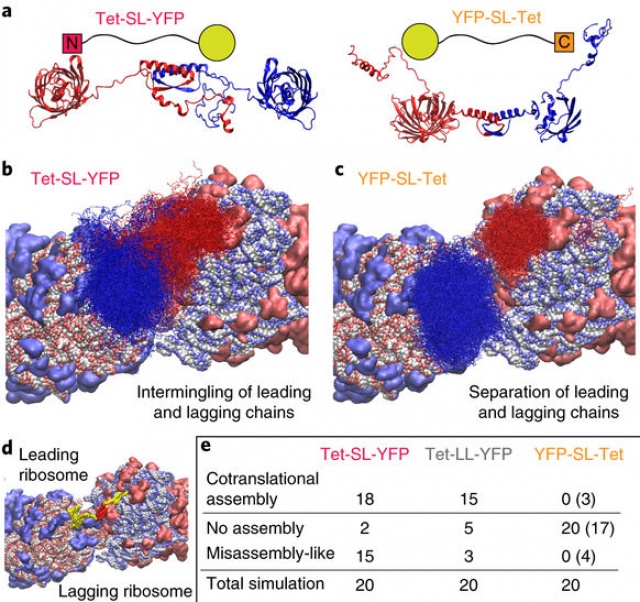 Számítógépes modell különböző struktúrák kotranszlációs feltekeredéséről Forrás: Nature Structural and Molecular Biology/Eviatar Natan et al.
Számítógépes modell különböző struktúrák kotranszlációs feltekeredéséről Forrás: Nature Structural and Molecular Biology/Eviatar Natan et al.Kiemelt módszertani jelentőség
A kutatás jelentőségének értékelésekor kiemelt hangsúlyt érdemel a fehérjevizsgálat in vivo jellege, így ugyanis sokkal pontosabb képet kaphatunk a fehérjemolekulák valós viselkedéséről, mint akkor, ha a standard in vitro modellrendszerekben végeznénk ugyanezeket a vizsgálatokat – mondja Kintses Bálint, a Kísérleti Evolúcióbiológiai Csoport tudományos munkatársa.
A fehérjék negyedleges térszerkezetének kialakulása ugyanis közel sem biztos, hogy élethűen modellezhető kémcsőben, vizes oldatban, mert az in vitro vizsgálati közeg eltér a sejt tényleges mikrokörnyezeti adottságaitól, ahol az egymással szoros közelségben lévő molekulák szükségképpen hatnak egymásra (ez az ún. macromolecular crowding jelensége). Lényegében ez az egyik oka, hogy a kotranszlációs feltekeredés többnyire fontos védő mechanizmusként vesz részt a funkcionális fehérjék kialakításában: a nem azonos alegységekből felépülő fehérjék esetében a szintézis közbeni gyors feltekeredés az egyik módja annak, hogy a sejt kivédje a nem megfelelő molekularészletek kölcsönhatását a „zsúfolt” intracelluláris mikrokörnyezetben, és ezzel megelőzze az aggregációt.
Ugyanez a mechanizmus az azonos alegységekből (homooligomerekből) álló fehérjemolekulák esetében hátrányt jelent(het), mert az egyforma alegységek szintézise egymáshoz nagyon közel folyik, ebből adódóan pedig fennáll az esélye, hogy a komplex proteint alkotó fehérjeegységek a felépülési folyamat nagyon korai fázisában találkozzanak, és már „félkész” állapotban összeépüljenek.
Az ilyen, homooligomer típusú fehérjék számára tehát előnyösebb, ha az interakciós felszín a fehérjemolekula végéhez esik közelebb, mert ezzel kivédhető az idő előtti alegység-összekapcsolódás. Természetesen sok más védőmechanizmus is létezik a sejtben, ami fiziológiásan hozzájárul az aggregáció megakadályozásához (ilyenek például a chaperon fehérjék), a fehérjekutatás szempontjából azonban nagy jelentőségű a fenti összefüggés bizonyítása, mert azt igazolja, hogy az élő szervezet sejtjeiben egyfajta szelekciós nyomás érvényesül a fehérjék számára.
Távlatok
Ha jobban megismerjük, milyen tényezők befolyásolják a funkcióképes fehérjekomplexek kialakulását, az lehetőséget adhat arra, hogy megfelelő módszerekkel befolyásolni tudjuk a fehérjeképződés „transzlációs miliőjét”, vagyis azt a környezetet, amikor a fehérje a legérzékenyebb az aggregációra. Ez új utakat nyithat például a neurodegeneratív idegrendszeri betegségek kutatásában. Jó példa lehet erre a Huntington-kór, amelyben egy olyan fehérje aggregálódik, amiben az interakciós felszín a fehérje elején található.
Az a mostani felismerés, hogy az ilyen típusú fehérjéknél az aggregáció már a fehérjeszintézis közben lezajlik, idővel új kezelési vagy akár prevenciós stratégiákat adhat az orvostudomány kezébe. Jelenleg egyre inkább előtérbe kerülnek az in vivo kutatási módszerek, amelyek lehetővé teszik, hogy valós környezetben vizsgáljuk a sejten belüli élettani és kórélettani folyamatokat, tehát az MTA SZBK-ban végzett automatizált mikroszkópos sejtvizsgálatok világviszonylatban is kiemelkedőek.




