Világelső módszerrel vizsgálták a forgást biomolekuláris gépezetben az MTA kutatói
Elsőként határozta meg a forgási sebességet egy forgómozgást végző fehérjekomplexben az MTA Szegedi Biológiai Kutatóközpont egy munkacsoportja a komplex bármiféle módosítása nélkül, annak természetes környezetében. A fehérje nem csupán reagál a hangfrekvenciás elektromos jelekre, hanem az oszcilláló elektromos tér szinkronizálni is tudja az egyes fehérjék forgását, aminek pedig biotechnológiai jelentősége van.
A biomolekuláris gépezetek bonyolult, motorszerű működésük miatt a biológiai és biofizikai kutatások frontvonalában szerepelnek. Ezek közül is nagy kihívást jelent a kutatók számára az úgynevezett forgó enzimek családja, amelyben bizonyos alegységek rotordoménnek nevezett csoportja forgómozgást végez a fehérjekomplex többi alegységéhez képest. Ez a biomembránon keresztül történő ionmozgással is összefüggésben van. Az egyik legismertebb ilyen forgó enzim a sejtek központi energiaforrását, az adenozin-trifoszfátot (ATP) előállító ATP-szintetáz, amelynek vizsgálata során először merült fel a katalitikus forgó enzimműködés (amiért egyébként Paul D. Boyer és John E. Walker 1997-ben megosztott kémiai Nobel-díjat kapott). Ilyen biomolekuláris gépezetek esetén
az egyik logikus alapkérdés, hogy milyen gyors a forgás, és hogyan függ külső tényezőktől.
A kérdés megválaszolása kapcsán mostanáig csak olyan kísérletekről számolt be a szakirodalom, amelyekben a vizsgált forgó enzimet kiemelték természetes membránkörnyezetéből, és bizonyos részeit genetikailag, kémiailag, sőt legtöbbször mechanikailag is módosították, hogy a forgómozgás mikroszkópban közvetlenül vagy spektrométerben közvetve megfigyelhető és mérhető legyen.
Csakhogy ezek a beavatkozások maguk is jelentősen módosítják a forgó enzim működését. Ezért az adatok nagy szórást mutatnak a szakirodalomban, és egyik forgó enzim esetében sincs adatunk arról, hogy milyen gyors a forgás egy natív, módosítatlan forgó enzimben, amikor az természetes környezetében van.
 A V-ATPáz ún. erősen csatolt forgó mechanizmusa. A rotor mindegyik c alegységéhez kötődik proton, amikor azok a membránlipidekkel érintkeznek. A protonok a c és a alegységek közötti, csak az egyik irányba nyitott hidrofil zsákokon keresztül érkeznek és távoznak a kötőhelyükről. A protonoknak a csatornában való mozgását a rotor forgása eredményezi, ami pedig az ATP hidrolíziséből létrejövő forgatónyomaték következménye. Az erős csatolás azt is jelenti, hogy ha a protonok kötődése vagy leválása (így a proton mozgása is) külsőleg blokkolódik, akkor a forgás és az ATP-bontás is leáll Ábra: Scientific Reports/Ferencz et al.
A V-ATPáz ún. erősen csatolt forgó mechanizmusa. A rotor mindegyik c alegységéhez kötődik proton, amikor azok a membránlipidekkel érintkeznek. A protonok a c és a alegységek közötti, csak az egyik irányba nyitott hidrofil zsákokon keresztül érkeznek és távoznak a kötőhelyükről. A protonoknak a csatornában való mozgását a rotor forgása eredményezi, ami pedig az ATP hidrolíziséből létrejövő forgatónyomaték következménye. Az erős csatolás azt is jelenti, hogy ha a protonok kötődése vagy leválása (így a proton mozgása is) külsőleg blokkolódik, akkor a forgás és az ATP-bontás is leáll Ábra: Scientific Reports/Ferencz et al.Újszerű megoldás
Az MTA Szegedi Biológiai Kutatóközpont (MTA SZBK) Biofizikai Intézetének egy munkacsoportja az eddigiektől merőben eltérően közelítette meg a kérdést. Eredményeikről a Nature lapcsoporthoz tartozó Scientific Reports online és szabad hozzáférésű (open access) folyóiratban számoltak be; a tanulmány március 27-én jelent meg. A munkacsoport irányítója Páli Tibor, az MTA doktora, az MTA SZBK tudományos tanácsadója, a Membrán Biofizika Kutatócsoport vezetője volt.
„Az alapötletet az adta, hogy egy-egy adott forgó enzimben nemcsak a forgás és a kémiai reakciók mutatnak periodicitást, hanem minden bizonnyal a töltések mozgása is, mind a szállított, mind a fehérje saját töltései esetében” – mondta Páli Tibor az mta.hu-nak. Tehát ha egy ügyes elrendezésben elektródák segítségével oszcilláló elektromos tér hatásának tesznek ki egy forgó enzimet, akkor annak működésében a változásnak maximálisnak kell lennie akkor, amikor az elektromos tér periódusideje megegyezik az enzim legnagyobb töltésmozgásainak periódusidejével. Amennyiben pedig a működés követése a felhasznált kémiai anyagok változásának mérésével történik, akkor az effektus elvileg mérhető akár természetes membránban is, a forgó enzim bármiféle módosítása nélkül.
A munkacsoport a vizsgálatokat a vakuoláris proton-ATPáz (V-ATPáz) forgó enzimen végezte. A V-ATPáz egy kulcsfontosságú enzim, egy biomembránbeli motorfehérje, ami ATP-t használ, és forgó mechanizmusa révén protont pumpál különféle sejtmembránonokon keresztül. A V-ATPáz minden sejtmaggal rendelkező sejtben előfordul. Fő funkciója a sejtszervecskékben és a sejtek közötti térben a citoplazmáétól eltérő hidrogénion- (proton) koncentráció (vagyis pH) fenntartásához szükséges aktív protontranszport. Bizonyos betegségekben megfigyelték a V-ATPáz normálistól eltérő működését is, például daganatok áttétképződése során, csontritkulásban vagy gyomorsavtúltengésben.
A mintegy másfél évtizedig tartó kísérletsorozatban a mérési körülmények (membránizolálás, mintaelrendezés, hőmérséklet, alkalmazott feszültség, kémiai anyagok koncentrációja stb.) optimalizálása volt a legnehezebb – számolt be Páli Tibor. A másik ok, ami az effektus alapos körbejárását indokolta, hogy egy korábban soha nem látott, rezonanciaszerű csúcsot figyeltek meg az enzimaktivitásnak az elektromos tér frekvenciájától való függésében, amit az eddigi, az oszcilláló elektromos tér fehérjékre gyakorolt hatását leíró elmélettel nem lehetett értelmezni. Ennek a csúcsnak a frekvenciájából határozták meg a rotor forgási frekvenciáját, ami 13,2 ± 0,5 Hz-nek adódott (standardizált mérési körülmények között). Egy modellel sikerült értelmezniük a rezonanciacsúcsot és a frekvenciafüggés határértékeit is.
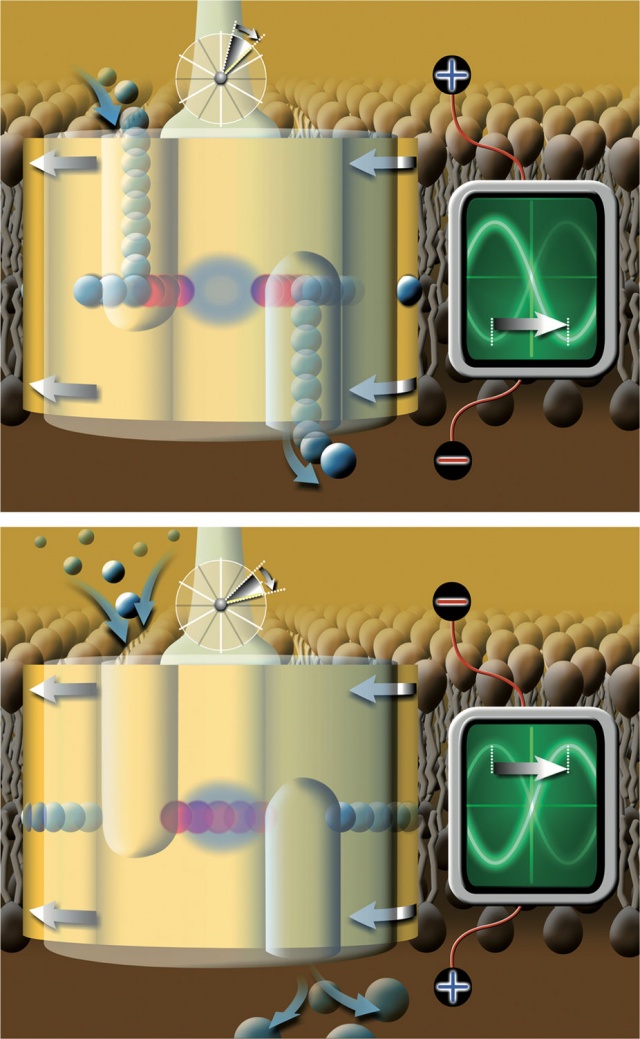 A V-ATPáz protonszállításának és az oszcilláló elektromos tér fázisainak illeszkedése abban az esetben, amikor az oszcilláló tér frekvenciája megegyezik a rotor 60 fokos elfordulásának frekvenciájával.
A V-ATPáz protonszállításának és az oszcilláló elektromos tér fázisainak illeszkedése abban az esetben, amikor az oszcilláló tér frekvenciája megegyezik a rotor 60 fokos elfordulásának frekvenciájával. Felső panel: Protonkötés és -felszabadulás (vagyis szállítás) lehetséges, mert két szomszédos kötőhely a megfelelő hidrofil zsákokban van. Amennyiben az elektromos tér a „jó” irányba mutat, úgy segíti, különben akadályozza a protonszállítást s így az enzim működését is.
Alsó panel: Protonkötés és -felszabadulás nem lehetséges, mert nincs kötőhely a hidrofil zsákokban. Ebben a forgási fázisban az elektromos térnek nincs hatása a protonszállításra, akkor sem, ha „rossz” irányba mutat. Ábra: Scientific Reports/Ferencz et al.
A közleményhez csatolt egyszerű és szemléletes animációk illusztrálják a V-ATPáz forgó mechanizmusát, azon belül az ATP-kötés, az ADP és inorganikus foszfát felszabadulása, a protonkötés, -felszabadulás és -szállítás időzítését a rotor forgása során, eltérő feltételek között. Ezek a következők:
- normál működés, amikor bőven van ATP; az animáció végén látható egy specifikus gátlóanyag hatása is (1. videó)
- lassú működés alacsony ATP-koncentráció miatt (2. videó).
A V-ATPáz rotorjának forgása és a proton mozgása olyan, szinuszosan oszcilláló elektromos tér hatása alatt, amelynek frekvenciája
Izgalmas alap- és alkalmazott kutatási kérdések
Az eredményekből az is következik, hogy a hangfrekvenciás oszcilláló elektromos tér képes szinkronizálni a biomembránban azonos irányban álló V-ATPáz enzimek forgását és katalitikus működését. Ez pedig előrevetíti annak lehetőségét, hogy ilyen módon akár kémiai, elektromos és mechanikai oszcillációk idézhetők elő sejtekben is. Továbbá – mivel az alkalmazottnál nagyobb elektromos terek is előfordulnak sejtekben – ilyen csatolt oszcillációk külső elektromos tér nélkül, természetes módon is előfordulhatnak. Ezek a következtetések új, izgalmas alapkutatási kérdéseket vetnek fel, de például a biotechnológiai alkalmazással kapcsolatban is új lehetőségek nyílnak. „Különösen büszke vagyok arra, hogy a munkát az ötlet megszületésétől a kísérleteken és adatkiértékelésen át a publikálásig az MTA SZBK Biofizikai Intézet dolgozóiból szerveződött csapat végezte Szegeden, és a projektet kizárólag hazai pályázatokból finanszíroztuk” – mondta Páli Tibor.
A kutatócsoport-vezető tájékoztatása szerint a projekt több új irányán is elkezdtek dolgozni az MTA SZBK Biofizikai Intézetének Membrán Biofizika Kutatócsoportjában. Elsősorban továbbra is a V-ATPázzal foglalkoznak, de a cikkben leírt módszerük valószínűleg más ionmozgató enzimek esetén is alkalmazható. Az új irányok közül a laikusok számára talán a legérdekesebb, hogy olyan komplex elektromos jeleknek a fehérjékre gyakorolt hatását is tanulmányozzák a hangfrekvenciás frekvenciasávban, mint amilyen például a zenelejátszás közben a hangszóróba, fejhallgatóba, majd onnan a fülünkbe jutó hullámformák. Ezekről az eredményeikről az idén várható újabb közleményük.




