Bennünk ketyegő biológiai órák – egy Nobel-díjas felfedezés története
A 2017-es orvosi Nobel-díjat az élőlények napi ritmusát szabályozó molekuláris mechanizmusok leírásáért kapta Jeffrey C. Hall, Michael Rosbash és Michael W. Young. Vendégszerzőink, Kozma-Bognár László és Nagy Ferenc, az MTA SZBK Növénybiológiai Intézet kutatói cikkükben betekintést adnak e biológiai folyamatok részleteibe, és végigvezetik az olvasót a felfedezés történetén.
A biológiai időmérés, a biológiai órák működése
A 2017-ben a Nobel Alapítvány az orvosi és élettani kutatások Nobel-díját megosztva annak a három kutatónak – név szerint Jeffrey C. Hallnak, Michael Rosbashnak és Michael W. Youngnak – ítélte, aki feltárta és lefektette a cirkadián óra működési mechanizmusának molekuláris alapjait. Munkájuk lehetővé tette annak megértését, hogy a bolygónkon kialakult élő szervezetek miként mérik az idő múlását.
Az élő szervezetekben többféle biológiai óra ketyeg, de ezek közül messze a legfontosabb a cirkadán óra, amelynek működése az élőlények döntő többségét képessé teszi arra, hogy a környezetükben a Föld forgása miatt bekövetkező, periodikusan, 24 óránként ismétlődő változásokra – pl. fény/sötét, magas/alacsony hőmérséklet – előre felkészüljön. Ennek a látszólag egyszerű „képességnek” óriási adaptációs jelentősége van, így nem véletlen, hogy a környezethez való alkalmazkodás e végtelenül kifinomult módja az evolúció során többször és egymástól függetlenül is kialakult, a kékbaktériumoktól kezdve a gombákon, növényeken és rovarokon át az emberig.
Az, hogy cirkadián típusú (circa diem = ’körülbelül egy napi’), azaz 24 óránként monoton ismétlődő ritmusok léteznek, régóta ismeretes. Az egyik legkorábbi megfigyelést még a XVIII. században tette egy francia tudós, amikor észrevette, hogy a mimózalevelek napi ritmikus mozgása (nappal/fényben kinyílnak, éjszaka/sötétben összecsukódnak) állandóan sötétben tartott növényeken is megfigyelhető. Ez és még több későbbi, hasonló tartalmú megfigyelés azt sejtette, hogy az ilyen, állandó környezeti felételek mellett is ritmikusan ismétlődő jelenségek mögött egy belső, autonóm biológiai időmérő működése áll.
Természetesen ahhoz, hogy ennek a szabályozásnak legyen élettani „értelme”, a belső ritmust adó molekuláris oszcillátor által mért időt összhangba kell hozni a környezetben mért abszolút, fizikai idővel, és az oszcillátor által generált ritmusnak meg kell nyilvánulnia egy jól definiálható, 24 órás periodicitást követő fiziológiás válasz formájában. A fentiek alapján tömören fogalmazva kijelenthető, hogy a cirkadián rendszer alkotóelemei a belső, autonóm biológiai óra, az ún. bemeneti jelátviteli lánc – ez juttatja el a belső órához azokat a környezeti információkat (fény, hőmérséklet stb.), amelyek lehetővé teszik a belső óra idejének összehangolását a külső idővel – és az ún. kimeneti oldal. Ez a kimeneti oldal teszi lehetővé, hogy a belső óra modulálja pl. egyes gének kifejeződésének szintjét, fehérjék stabilizációját/lebontását vagy különböző metabolitok aktuális koncentrációját – végső soron élettani folyamatokat, így téve lehetővé a környezethez való optimális alkalmazkodást.
Az ecetmuslica cirkadián órájának működési mechanizmusa
Jeffrey C. Hall, Michael Rosbash és Michael W. Young az ecetmuslica (Drosophila melanogaster) cirkadián órájának működését tanulmányozva tették meg korszakalkotó felfedezéseiket. Első kísérleteik idején, az 1980-as évek elején, már egyre inkább elfogadottá vált az a hipotézis, hogy a cirkadián óra működését speciális gén(ek), az ún. „óragének” szabályozzák.
Ennek a koncepciónak szilárd alapot adtak Seymour Benzer és Ronald Konopka kísérletei (Konopka–Benzer 1971).Ők olyan mutáns legyeket azonosítottak, amelyekben két, cirkadián ritmust követő fiziológiás válasz módosult formában volt megfigyelhető. Az egyik mutánsban ezek a válaszok egyáltalán nem mutattak cirkadián ritmust, aritmikusak voltak, a másik mutánsban a válaszok periódushossza több volt, mint 24 óra, a harmadik mutánsban észlelt periódushossz pedig rövidebb volt 24 óránál. Benzer és Konopka eredményeik alapján feltételezték, hogy az aberráns ritmusért egyetlen gén különböző mutációi a felelősek, s a gént elnevezték „period”-nak.
Hall, Rosbash és Young 1984-ben közölték azokat a cikkeket (Bargiello–Young 1984; Reddy és mtsai 1984; Zehring és mtsai 1984), amelyekben beszámoltak a hipotetikus period gén molekuláris azonosításáról, meghatározták a gén szekvenciáját, és bizonyították, hogy a vad típusú, nem mutáns period gén kifejeztetésével a mutánsok aberráns fenotípusa korrigálható. A period gén szekvenciája, illetve az általa kódolt PER fehérje azonban nem adott semmiféle kézzelfogható magyarázatot arra, hogyan működik a muslica cirkadián órája, azaz milyen szerepet játszik a period gén és az általa kódolt PER fehérje a 24 órás ritmus generálásában.
A tudomány rohamléptekkel halad előre, de még így is több mint tíz évet kellett várni arra, hogy a kérdést megnyugtató módon meg lehessen válaszolni. A Nobel-díjjal idén kitüntetett tudósok kísérleteikkel először bizonyították, hogy a PER fehérje elsősorban a muslicák agyi neuronjaiban fejeződik ki, és a szintje amellett, hogy jól kimutathatóan követ egy 24 órás ritmust, az éjszaka közepén éri el a maximumát (Siwiczki és mtsai 1988).
Röviddel később kimutatták, hogy a period-mRNS szintjének maximuma órákkal megelőzi a PER protein maximális szintjét (Hardin és mtsai 1990), és hogy a PER protein magas szintje gátolja a period-mRNS felhalmozódását. Ezzel szinte egy időben felfedezték, hogy a PER fehérje vándorol a sejtmag és a citoplazma között (Liu és mtsai 1992), majd valamivel később azonosítottak egy újabb gént, a timelesst, és bizonyították, hogy a timeless gén és terméke, a TIM fehérje is elengedhetetlenül szükséges a 24 órás ritmus kialakulásához (Sehgal és mtsai 1995).
Rövid időn belül kiderült, hogy a TIM-mRNA felhalmozódásának maximuma és minimuma szintén egy 24 órás periódust követ, illetve hogy a TIM fehérje kötődik a PER fehérjéhez és befolyásolja annak sejtmagba történő bejutását. Kimutatták továbbá, hogy a period-mRNS kifejeződése sérül a timeless-mutáns legyekben, ugyanakkor a timeless-mRNS periodikus expressziója hasonló módon elvész period-mutánsokban (Gekakis és mtsai 1995; Sehgal és mtsai 1994).
Ezekre a kísérleti adatokra támaszkodva született meg az az úttörő koncepció, amely szerint a cirkadián ritmus generálásáért, fenntartásáért az óragének transzkripciós-transzlációs visszacsatolásos hurokkal történő, önfenntartó szabályozása a felelős (Transcriptional-Translational Feedback Loop, TTFL). A koncepció megszületett, de azok a gének, amelyek a timeless és period gének transzkripciójának aktiválásáért felelősek, csak később váltak ismertté. A clock és cycle géneket 1998-ban azonosították (Allada és mtsai 1998; Rutila és mtsai 1998) majd rövidesen bizonyították, hogy a CLOCK és CYCLE fehérje heterodimereket képez, és pozitívan szabályozza a period és timeless gének transzkripcióját. Valamivel később azt is bizonyították, hogy a PER és TIM fehérjék negatívan szabályozzák a CLOCK fehérje aktivitását, és ezzel a felfedezéssel a cirkadián visszacsatolásos hurok bezárult (Darlington és mtsai 1998).
A cirkadián rendszer szerveződése, élettani funkciói
A cirkadián óra jelenlegi molekuláris modellje a fenti géneken kívül számos más komponenst is tartalmazó, bonyolult szabályozó rendszer, amelynek működése kielégítően magyarázza a cirkadián ritmus hihetetlen stabilitását. Emellett a jelenlegi modell már tartalmazza azokat a géneket, géntermékeket is, amelyek lehetővé teszik a külső és a cirkadián óra által mért idő összehangolását, azaz a cirkadián óra naponta ismétlődő újbóli beállítását (bemeneti oldal), illetve azokat a jelátviteli láncokat és molekuláris történéseket, amelyek révén az óra által generált ritmus megnyilvánul az egyes fiziológiás válaszok ritmikus ismétlődésében (Hardin 2011).
Az utóbbi évek kutatásai azt a régi sejtést is bizonyították, hogy a többsejtű élőlények szinte minden sejtjében működik egy molekuláris oszcillátor, és hogy az egyes sejtek órái közti kapcsolat jellege az egyes organizmusok között jelentősen eltér. Emlősökben egyértelmű hierarchia tapasztalható: a központi óra, amely a viselkedési ritmusok kizárólagos szabályozója, a hipotalamusz szuprakiazmatikus magjának (SCN) idegsejtjeiben található, és humorális vagy idegi úton képes modulálni a perifériás szövetekben (vázizomzat, máj, vese) működő órák fázisát és amplitúdóját. A perifériás órák fő feladata pedig az adott szerv/szövet metabolikus funkciójának napszakos időzítése (Mohawk és mtsai 2012). Az egyes órák egymással és a környezeti ciklussal való szinkronizációja egyaránt fontos, mivel a cirkadián óra csak így töltheti be szerepét az egyed szintjén. A retinából származó nem vizuális jelek közvetlenül beállítják az SCN-ben működő központi órát, amely aztán képes testszerte összehangolni a perifériás órák működését. Ez utóbbiak közvetlenül nem érzékenyek fényre, de hőmérséklettel vagy táplálkozásból származó metabolitokkal hatékonyan szinkronizálhatók.
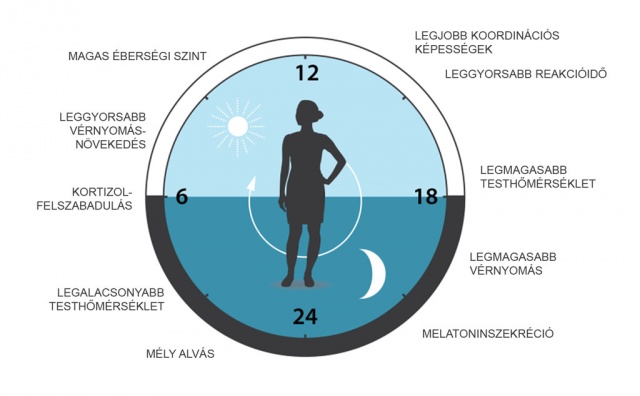
A cirkadián óra által időzített emberi élettani és molekuláris szintű folyamatok meglehetősen sokrétűek, bár a szabályozás jelentőségét általában csak akkor ismerjük fel, amikor valamilyen zavart szenved. A vérnyomás, a testmag hőmérséklete, de jelentős hormonok, mint például a kortikoszteroidok vagy az inzulin, termelődése is napszakos ritmust mutat (Son és mtsai 2008). Az óra szabályozza az inzulinérzékenységet és vércukorszintet is, ezáltal pedig a szervezet metabolikus állapotának napszakos változásait (Panda 2016).
Ezek alapján érthető, hogy az óra abnormális működése az aktivitásritmusok elrontása mellett súlyosabb kórképek kialakulásához is vezethet. Az alvásproblémák bizonyos esetei szintén a cirkadián rendszer megzavart állapotára, a külső környezet és az óra által meghatározott ritmusok deszinkronizációjára vezethetők vissza. Ezeket a betegségeket gyakran kezelik fényterápiával (periodikus megvilágításokkal) annak érdekében, hogy az egyén cirkadián órája ismét a környezettel azonos fázisban működjön. A jet-lag közismert jelensége az óra és a környezet közti összhang sérülésének. Szociális jet-lagről akkor beszélünk, amikor az egyén cirkadián ritmusa jelentősen eltér a társadalmi normák, pontosabban a munkavégzés által meghatározott „környezeti” ciklustól. Mivel ez az állapot jellemzően tartósan fennáll, egészségkárosító hatása is jelentős lehet, ami daganatos megbetegedések, neurodegeneratív elváltozások, anyagcserezavarok gyakoribb előfordulásában nyilvánulhat meg (Hirota–Kay 2015).
 Forrás: nobelprize.org, mta.hu
Forrás: nobelprize.org, mta.huKronobiológiai műhelyek Magyarországon
Itthon csak néhány kutatócsoport foglalkozik a cirkadián órák és ritmusok vizsgálatával. Jelen írás szerzőinek munkacsoportja az MTA Szegedi Biológiai Kutatóközpontban a növényi óra felépítését, működését és az egyéb alapvető jelátviteli rendszerekkel való kölcsönhatását kutatja immár évtizedek óta. A csoport tagjai több fontos megfigyelést tettek a növényi cirkadián óra működésével kapcsolatban, pl. elsőként bizonyították, hogy a cirkadián óra növényekben is szabályozza a gének transzkripciójának napi ritmusát (Nagy és mtsai 1988), kimutatták, hogy az oszcillátor ritmikusan szabályozza azoknak a fotoreceptoroknak is a kifejeződését, amelyek funkciója a fény érzékelése és a jelek továbbítása a cirkadián oszcillátorhoz (Kozma-Bognár és mtsai 1999), aminek révén az óra képes saját fényérzékenységét időzíteni, és így stabilabb és robusztusabb oszcillációkat generál, és hozzájárultak annak igazolásához, hogy a növényekben a környezettel összhangban működő cirkadián rendszer mérhető növekedési-túlélési előnyhöz juttatja „gazdáját” (Dodd és mtsai 2005). Jelenlegi munkájuk a növényi cirkadián óra működ(tet)ésében fontos szerepet játszó új gének/fehérjék azonosítására és jellemzésére irányul, de vizsgálják az óra hatását fejlődésbiológiai folyamatokban is (Hajdu és mtsai 2015).
Káldi Krisztina csoportja a Semmelweis Egyetemen egy fonalas gomba modellszervezetben (Neurospora crassa) tanulmányozza a cirkadián oszcillátor működését. Kísérleteikben a reaktív oxigéngyökök és a molekuláris oszcillátor közti kétirányú kapcsolatot vizsgálták, illetve azt a mechanizmust kívánják feltárni, amelynek révén az oszcillátor képes megőrizni stabilitását a sejt esetenként jelentősen eltérő metabolikus állapotai mellett, de érdeklődésük kiterjed egyes emberi fehérvérsejtek funkcióinak cirkadián szabályozására is.
Csernus Valér csoportja a Pécsi Tudományegyetem Anatómiai Intézetében csirketobozmirigy-modellrendszerrel dolgozik. Kimutatták, hogy ez a szerv egy komplett cirkadián rendszert (bemenet, oszcillátor, kimenet) tartalmaz, ami izolált állapotban, in vitro körülmények között is képes önfenntartó és beállító jelekre érzékeny ritmusok létrehozására. Ez alapvető különbséget jelent a madarak és az emlősök tobozmirigye mint óraneuronokat tartalmazó központi idegrendszeri területek között.
Irodalomjegyzék
Allada, R., White, N. E., So, W. V., Hall, J. C., and Rosbash, M. (1998). A mutant Drosophila homolog of mammalian Clock disrupts circadian rhythms and transcription of period and timeless. Cell 93, 791–804.
Bargiello, T. A., and Young, M. W. (1984). Molecular genetics of a biological clock in Drosophila. Proc Natl Acad Sci USA 81, 2142–2146.
Darlington, T. K., Wager Smith, K., Ceriani, M. F., Staknis, D., Gekakis, N., Steeves, T. D., Weitz, C. J.,Takahashi, J. S., and Kay, S. A. (1998). Closing the circadian loop: CLOCK induced transcription of its own inhibitors per and tim. Science 280, 1599–1603.
Dodd, A. N., Salathia, N., Hall, A., Kevei, É., Tóth, R., Nagy, F., Hibberd, J. M., Millar, A. J., Webb, A. A. (2005). Plant circadian clocks increase photosynthesis, growth, survival, and competitive advantage. Science 309, 630–633.
Gekakis, N., Saez, L., Delahaye, Brown, A. M., Myers, M. P., Sehgal, A., Young, M. W., and Weitz, C. J. (1995). Isolation of timeless by PER protein interaction: defective interaction between timeless protein and long period mutant PER. Science 270, 811–815.
Hajdu A., Ádám É., Sheerin D. J., Dobos O., Bernula P., Hiltbrunner A., Kozma-Bognár L., Nagy F. (2015). High-level expression and phosphorylation of phytochrome B modulates flowering time in Arabidopsis. The Plant J. 83, 794–805.
Hardin, P. E. (2011). Molecular genetic analysis of circadian timekeeping in Drosophila. Adv. Genet. 74, 141–173.
Hardin, P. E., Hall, J. C., and Rosbash, M. (1990). Feedback of the Drosophila period gene product on circadian cyclin g of its messenger RNA levels. Nature 343, 536–540.
Hirota, T., and Kay, S. A. (2015). Identification of small molecule modulators of the circadian clock. Meth. Enzymol. 551, 267–282.
Konopka, R. J., and Benzer, S. (1971). Clock mutants of Drosophila melanogaster. Proc Natl Acad Sci USA 68, 2112–2116.
Kozma-Bognár, L., Hall, A., Ádám, É., Thain, S., Nagy, F., Millar, A. (1999). The circadian clock controls the expression pattern of the circadian input photoreceptor, phytochrome B. Proc. Natl. Acad. Sci. USA 96, 14652–14657.
Liu, X., Zwiebel, L. J., Hinton, D., Benzer, S., Hall, J. C., and Rosbash, M. (1992). The period gene encodes a predominantly nuclear protein in adult Drosophila. J Neurosci 12, 2735–2744.
Mohawk, J. A., Green, C. B., and Takahashi, J. S. (2012). Central and peripheral circadian clocks in mammals. Annu Rev Neurosci 35, 445–462.
Nagy, F., Kay, S., and Chua, N. H. (1988). Gene regulation by phytochrome. Trends in Genetics 4, 37–42.
Panda, S. (2016). Circadian physiology of metabolism. Science 354, 1008–1015.
Reddy, P., Zehring, W. A., Wheeler, D. A., Pirrotta, V., Hadfield, C., Hall, J. C., and Rosbash, M. (1984). Molecular analysis of the period locus in Drosophila melanogaster and identification of a transcript involved in biological rhythms. Cell 38 , 701–710.
Rutila, J. E., Suri, V., Le, M., So, W. V., Rosbash, M., and Hall, J. C. (1998). CYCLE is a second bHLH –PAS clock protein essential for circadian rhythmicity and transcription of Drosophila period and timeless. Cell 93, 805–814.
Sehgal, A., Price, J. L., Man, B., and Young, M. W. (1994). Loss of circadian behavioral rhythms and per RNA oscillations in the Drosophila mutant timeless. Science 263, 1603–1606.
Sehgal, A., Rothenfluh Hilfiker, A., Hunter-Ensor, M., Chen, Y., Myers, M. P., and Young, M. W. (1995). Rhythmic expression of timeless: a basis for promoting circadian cycles in period gene autoregulation. Science 270, 808–810.
Siwicki, K. K., Eastman, C., Petersen, G., Rosbash, M., and Hall, J. C. (1988). Antibodies to the period gene product of Drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1, 141–150.
Son, G. H., Chung, S., Choe, H. K., Kim, H.-D., Baik, S. M., Lee, H., Lee, H.-W., Choi S., et al. (2008). Adrenal peripheral clock controls the autonomous circadian rhythm of glucocorticoid by causing rhythmic steroid production. Proceedings of the National Academy of Sciences 105, 20970–20975.
Zehring, W. A., Wheeler, D. A., Reddy, P., Konopka, R. J., Kyriacou, C. P., Rosbash, M., and Hall, J. C. (1984). P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell 39, 369–372.
A címlapkép forrása flickr.com/Darren Tunnicliff.





