Új dimenzió a fehérjekutatásban: Fuxreiter Mónika cikke a Cell-ben
Mi a közös Steven Hawking világhírű brit fizikus betegségében, az egészséges szervezet stresszválaszában és a vírusfertőzések elleni védekezésben? Mindegyik folyamatban nagyszámú fehérjemolekula egymáshoz kapcsolódásával létrejövő, változó összetételű és szerkezetű képződmények vagy sejtszervecskék vesznek részt. Ezekben a környezeti hatásokra reagálva sokszor csekély változás is visszafordíthatatlan, betegséghez vezető folyamatokat indíthat el. Fuxreiter Mónika, az MTA-DE Lendület Fehérjedinamikai Kutatócsoport vezetője a fehérjék önszerveződésének alapvető összefüggéseit, az egészségesből kórossá történő átalakulások molekuláris hátterét tárta fel. Eredményeiről a Cell májusi számában számolt be.
 Fuxreiter Mónika
Fuxreiter Mónika„Az önszerveződések nemcsak szerkezetileg, hanem térben és időben is szabályozzák a fehérjék tevékenységét. Ez valamelyest hasonlít az emberek által létrehozott különböző szociális hálókhoz vagy közigazgatási egységekhez. A Cell májusi számában megjelent cikkA fehérjék esetében azonban keveset tudunk arról, hogy a magasabb rendű szerveződések hogyan vezérelhetők, illetve feladatukat ellátva miként szűnnek meg. Valószínű, hogy egyes képződmények megszüntetése összetett működésű fehérjegépezeteket igényel.
Nagyon izgalmas kérdés az is, hogy szerkezetileg miként jellemezhetők részletesen A magasabb rendű fehérjeszerveződések elmosódott szerkezeti világa (Fuxreiter Mónika összefoglalója)a fehérjék magasabb rendű szerveződései. Méretük, változó összetételük és heterogén struktúrájuk miatt ugyanis ezeknek a rendszereknek a megismerése kihívást jelent a szerkezeti biológia eszköztára számára. A gyógyszerkutatások szempontjából ugyanakkor alapvető jelentőségű, hogy feltárjuk e fehérjekapcsolatok kialakulásának pontos szerkezeti mechanizmusát” – mondta el az mta.hu-nak Fuxreiter Mónika, az MTA-DE Lendület Fehérjedinamikai Kutatócsoport vezetője, a tanulmány szerzője.
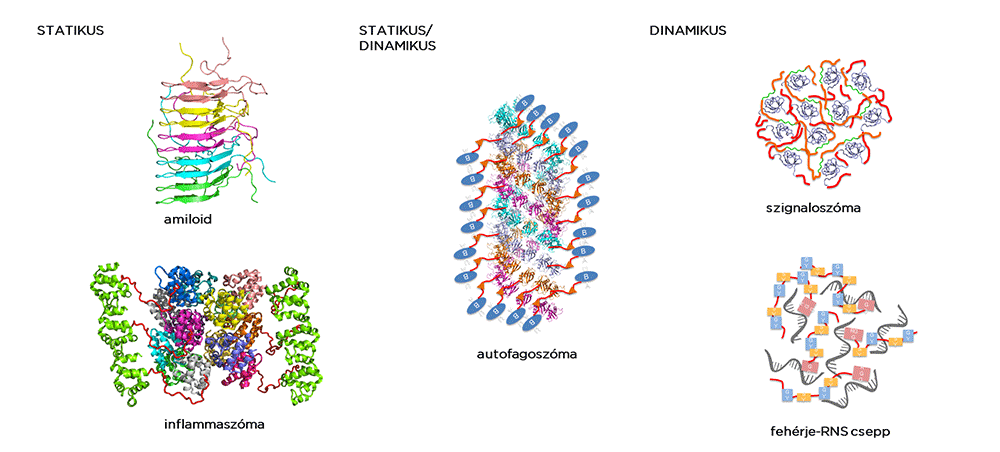 A magasabbrendű fehérjeszerveződések néhány típusa
A magasabbrendű fehérjeszerveződések néhány típusaPrionok a figyelem középpontjában
Számos neurodegeneratív betegség, például az Alzheimer- vagy a Parkinson-kór hátterében fehérjék működőképes szerkezetének elvesztése és egymással történő szoros összekapcsolódása áll. Ennek következtében merev, megbonthatatlan molekuláris aggregátumok jönnek létre, majd az agyban lerakódások képződnek. A legjobban ismert magasabb rendű fehérjeszerveződések az amiloidok és a prionok, amelyek az 1990-es évek elején az ugrásszerűen terjedő kergemarhakór, illetve a Creutzfeldt–Jakob-betegség kapcsán kerültek a figyelem középpontjába.
Az egészségestől a kóros szerveződésekig
„Kiderült azonban, hogy az amiloidok hasznos biológiai feladatokat is elláthatnak. Szerepük lehet például a pigmentképződésben vagy az immunrendszer védekezési folyamataiban. Ez utóbbi esetben a merev struktúrák kialakulása a fertőzéshez kapcsolódó molekuláris memóriaként is szolgál” –mondta Fuxreiter Mónika. Arról is beszélt, hogy az utóbbi években ismerték fel a fehérjék gyengébb kölcsönhatásai által létrejövő hatalmas jelátviteli komplexek, az úgynevezett szignaloszómák, valamint a hidrogél, illetve a folyékony állapotú membrán által nem körülhatárolt sejtszervecskék jelentőségét. Ezek dinamikusan változó összetétele és képlékeny szerkezete érzékenyen reagál a környezeti hatásokra és kulcsfontosságú a megfelelő biokémiai válasz elindításában.
„A fehérjéknek ezen magasabb rendű szerveződései a rákos folyamatok megelőzésében, számos gyulladásos folyamatban vagy a stresszválaszban játszanak szerepet, azonban szerkezeti alapjaikról, felépítésük alapelveiről ma még nagyon kevés információ áll rendelkezésre. Különösen érdekes, hogy a dinamikus fehérjeszerveződésekben már csekély zavar hatására is elindulhat egy visszafordíthatatlan átalakulás, amely merev aggregátumokat hoz létre. Ennek egyik legismertebb példája az amiotrófiás laterálszklerózisban (ALS) szenvedő világhírű elméleti fizikus, Steven Hawking esete, hiszen az ALS-betegséget okozó fehérje normális körülmények között a genetikai anyag átíródását szabályozza” – ismertette a Debreceni Egyetem Biokémiai es Molekuláris Biológiai Intézetének kutatója.
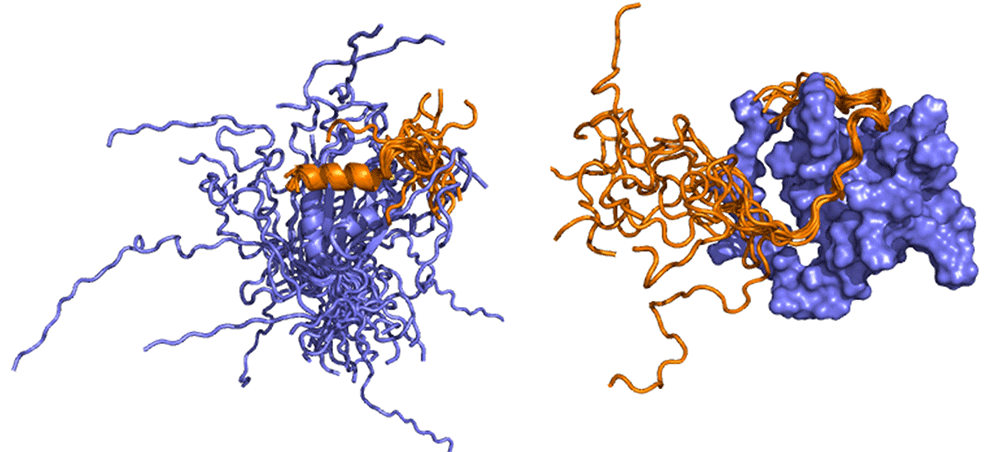 Elmosódott szerkezetű fehérjekomplexek, melyek a herpeszvírus fertőzésben (bal) illetve a leukémiában (jobb) játszanak szerepet
Elmosódott szerkezetű fehérjekomplexek, melyek a herpeszvírus fertőzésben (bal) illetve a leukémiában (jobb) játszanak szerepetFeltárt fizikai alapelvek
Fuxreiter Mónika elmondta: a Cell folyóiratban megjelent tanulmány azt vizsgálja, hogy találhatók-e közös jellegzetességek a különböző fehérjeszerveződésekben, s milyen molekuláris tényezők szabályozzák ezeket a képződményeket. A szerzőknek sikerült feltárniuk azokat a fizikai alapelveket, amelyek meghatározzák az önszerveződések struktúráját és dinamikáját.
„A fehérjék magasabb rendű szerveződéseit szabályos struktúrával nem rendelkező, elmosódott szerkezeti További információk az elmosódott szerkezetű komplexekről a kutató honlapjánhalmazokként értelmeztük (fuzzy structures). Ezzel elsőként sikerült egységes leírást adni a különböző „viselkedésű” fehérjeképződményekre és ennek alapján választ adni a fehérjék önszerveződésével kapcsolatos néhány alapvető kérdésre. Lehetővé vált továbbá azoknak a zavaroknak, perturbációknak a molekuláris magyarázata is, amelyek a különböző betegségeket okozó változásokat idézik elő. Ugyanakkor még számos nyitott probléma maradt, amelyre a megoldást a felvázolt általános irányelvek felhasználásával lehet keresni. A további kutatások irányát meghatározza az a felismerés, hogy a szabályos struktúrával nem rendelkező fehérjeszakaszok kritikus szerepet töltenek be az önszervező folyamatokban” – fogalmazott Fuxreiter Mónika.
További információ
Fuxreiter Mónika




