Halálba kergeti a tumorsejteket az új leukémiaellenes szer
A programozott sejthalál serkentésével pusztítja el a daganatokat az a kísérleti gyógyszerjelölt, melynek sikeréről – ritkaságként a lap tematikájában – a Nature folyóirat számolt be a közelmúltban. A nemzetközi szerzőgárda élén a Servier Kutatóintézet Zrt. magyar kutatói állnak. A kutatóintézet együttműködik az MTA TTK Szerves Kémiai Intézetével is.
Kiemelten foglalkozott a Nature azzal a rákellenes gyógyszerjelölttel, amelyet magyar vezetéssel fejlesztett ki egy nemzetközi kutatócsoport. Az új szer az úgynevezett programozott sejthalál folyamatát serkenti. A programozott sejthalál (idegen szóval apoptózis) az állatokban és az emberi szervezetben is folyamatosan zajló, természetes folyamat, amely a sérült, fertőzött vagy daganatos sejtek „öngyilkosságát” teszi lehetővé.
A Servier Kutatóintézet Zrt. által létrehozott gyógyszerjelölt-molekula több olyan előnyös tulajdonsággal is bír, amilyennel a korábbi, hasonló hatású szerek nem. Ez megkönnyítheti a folyamatot, hogy valóban gyógyszer váljon belőle.
A gyógyszerjelölt-molekulával nagyon jó eredményeket értek el leukémiás, limfómás és egyéb daganatos sejttenyészeteken, és ezeket az állatkísérletek során is meg tudták ismételni.
Blaskó Gábor akadémikus és Kotschy András, a Servier Kutatóintézet főigazgatója szerint az emberi (klinikai) próbák még az idén elindulhatnak. A kutatóintézet együttműködik az MTA TTK Szerves Kémiai Intézetével és több hazai egyetemmel is.
Az alábbiakban részletes beszámoló olvasható a témáról.
Programozott sejthalál: természetes védekezés a daganatok kialakulása ellen
Elsőként az állati egyedfejlődés tanulmányozása vezetett el a programozott sejthalálnak vagy apoptózisnak nevezett jelenség felismeréséhez. Az apoptózis során egy soksejtű szervezet sejtjei szabályozott módon, a szervezet élettani igényeinek megfelelően pusztulnak el. A Sydney Brenner által az 1950-es évek végén megkezdett, majd John Sulston és Robert Horvitz által a 70-es, 80-as években kiteljesített munkát 2002-ben ismerte el orvosi-élettani Nobel-díjjal a tudományos közösség. S bár az apoptózis folyamatának felderítése eredetileg a Caenorhabditis elegans fonalféreg kutatásából indult ki, nem tellett sok időbe, míg nyilvánvalóvá vált, hogy a felfedezett mechanizmus jóval általánosabb érvényű: nemcsak valamennyi fejlődő állati szervezet formálásában játszik kulcsszerepet, hanem létfontosságú a felnőtt szövetek „karbantartásában” (homeosztázisának fenntartásában) is.
Míg az egyedfejlődés során az apoptózis a szükségtelenné vált sejtek eltüntetéséről gondoskodik, addig a felnőtt szervezetben a daganatos burjánzás ellen beépített „fékek és ellensúlyok” egyik legfontosabbjaként őrködik sejtjeink sorsa felett. Azáltal, hogy meggátolja a károsodott sejtek osztódását, és öngyilkosságra kényszeríti őket, az apoptózis megvédi a szervezetet a sérült vagy fertőzött sejtek további szaporodásának veszélyes következményeitől. Ahhoz tehát, hogy egy daganat a genetikai anyag károsodása ellenére az immunrendszer és a daganatellenes kezelés támadásai közepette is túléljen és növekedjék, a tumorsejteknek nem elég potenciálisan korlátlan osztódóképességgel rendelkezniük, de ellenállóvá kell válniuk az őket az apoptózis felé terelő impulzusokkal szemben is.
A gátlás gátlásának gátlása
Az apoptózis szabályozásának középpontjában a BCL-2 fehérjecsalád egymással ellentétes hatású tagjai állnak. A család egyik fele, amelybe az elsőként felfedezett, névadó BCL-2 is tartozik, az apoptózist gátló (antiapoptotikus) fehérjéket tartalmaz, míg a család másik fele az apoptózist serkentő (proapoptotikus) hatású. A daganatokban értelemszerűen az antiapoptotikus hatásnak kell túlsúlyba kerülnie; a BCL-2 daganatkeletkezésben játszott szerepét is úgy ismerték fel, hogy a nyirokdaganatok egy csoportjában a BCL-2 jelentős mértékben túltermelődik, s a klasszikus daganatkeltő génekkel (onkogénekkel) együttműködve biztosítja a tumorsejtek túlélését.
A BCL-2 család mindkét felének tagjaira jellemző a BH doménnak nevezett fehérjemotívumok jelenléte, amelyek a tagok közötti kölcsönhatásokat közvetítik. Az apoptózis kiváltásához az szükséges, hogy a proapoptotikus tagok az ún. BH3 doménjukon keresztül kötést létesítsenek az antiapoptotikus tagok specifikus kötőzsebével, s ezáltal blokkolják az utóbbiak működését.
Ez a kölcsönhatás régóta foglalkoztatja az onkológiai gyógyszerkutatókat, és több olyan, a BH3 domén apoptózisserkentő hatását utánzó (BH3-mimetikus) hatóanyagot sikerült kifejleszteni, amely ígéretes tumorellenes aktivitást mutat. A sokéves kutató-fejlesztő munka nemrégiben meghozta első gyümölcsét: a BCL-2 működését blokkoló venetoclax 2016 áprilisában elnyerte az Egyesült Államok gyógyszerhatóságának engedélyét a krónikus nyiroksejtes leukémia egy altípusának kezelésére.
Rendkívül ígéretes gyógyszerjelölt magyar vezetésű fejlesztéssel
De ezzel a történet természetesen nem ér véget, sőt, most válik csak igazán izgalmassá. A BH3-mimetikus, apoptózist serkentő szerek további fejlesztésének jelentős lendületet adott a Food and Drug Administration pozitív döntése, s lehetséges, hogy a venetoclax sikerét éppen az a vegyület fogja megismételni, amelyet – több nemzetközi partnerrel együttműködésben – a Servier Kutatóintézet Zrt. magyar kutatói segítettek napvilágra. A Nature folyóirat 2016. évi utolsó számainak egyikében egy olyan onkológiai gyógyszerjelölt molekuláról jelent meg híradás Kotschy András, az MTA doktora és a Servier Kutatóintézet főigazgatója tollából, amely a BCL-2 családba tartozó MCL1 antiapoptotikus fehérje gátlásán keresztül egy sor különböző daganattípus leküzdésében hatékonynak bizonyult. Az S63845 munkanéven bejegyzett vegyület mind sejttenyészetben, mind kísérletes egérmodellekben sikerrel vette fel a harcot a legkülönbözőbb leukémiákkal és limfómákkal szemben, és más szerekkel kombinálva még egyes nem vérképzőszervi tumorsejtvonalakban is számottevő sejtpusztulást váltott ki. Az S63845-tel sikeresen támadható daganatfélék közös vonása, hogy valamennyiük túlélése az MCL1 rendellenes túlműködésétől függ.
„A Nature-közleményben ismertetett S63845 molekula a különböző leukémiás megbetegedések kialakulásában szerepet játszó MCL1 protein gátlásával éri el a tumoros sejtek programozott sejthalálát, ily módon megakadályozza a tumor növekedését, illetve kiváltja a meglevő tumoros szövetek visszafejlődését – magyarázza Kotschy professzor. – Az új mechanizmust felhasználó gyógyszerjelölt a jelenlegi kísérleti bizonyítékok szerint elpusztítja az MCL1-függő tumoros sejteket például a mieloid leukémia, a mielóma multiplex, a leukémia és a limfóma esetében.” Kotschy András hangsúlyozta: jelentős eredmény, hogy a kedvező biológiai hatást viszonylag kis molekulatömegű molekulával érték el, ami feljogosít arra a reményre, hogy az új, szintetikus gyógyszerjelöltből megfelelő gyógyszerbiztonsági tulajdonságokkal rendelkező vegyület fejleszthető majd ki. A kísérleti adatok alapján az új molekula gyógyszer-kombinációkban jól beilleszthető lesz a létező daganatterápiás protokollokba, de a kutatók abban bíznak, hogy akár egyedül alkalmazott gyógyszerként is megállja majd a helyét.
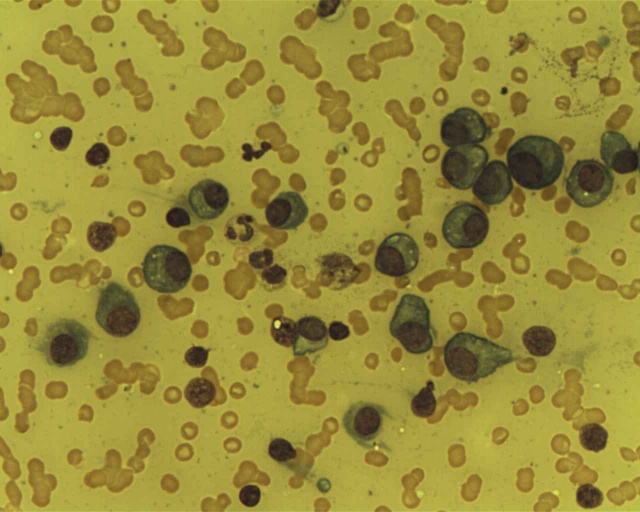 Egy mielóma multiplexben szenvedő beteg plazmasejtjei Forrás: Wikimedia Commons/Dr Erhabor Osaro - CC-BY-SA
Egy mielóma multiplexben szenvedő beteg plazmasejtjei Forrás: Wikimedia Commons/Dr Erhabor Osaro - CC-BY-SATöbb szempontból is jobb az eddigieknél
Az S63845-nek van néhány olyan előnyös tulajdonsága, amilyennel egyik elődje sem büszkélkedhetett. Először is az új gyógyszerjelölt a céltudatos, szerkezetvezérelt molekulatervezés eredményeképpen 20-szor erősebben kötődik célpontjához, az emberi MCL1-hez, mint a korábbi legjobb MCL1-gátlószer, az A-1210477. Ez azt jelenti, hogy kisebb dózisban is hatékony, célmolekuláját tartósabban blokkolja, és kevésbé hajlamos nem kívánt célpontokhoz kapcsolódni. Másodszor, az A-1210477-tel ellentétben az S63845 kevésbé kötődik a vérszérum fehérjéihez. Ez azért kedvező, mert a szérumfehérjékhez kikötődő gyógyszermolekulák a szervezetbe adva mintegy „elnyelődnek” a vérben, és a beadottnál jóval kisebb tényleges koncentrációban jutnak el a sejtek belsejébe. Az S63845 esetében kisebb ez a veszteség, tehát a beadott anyag sokkal nagyobb arányban hasznosul. E két fontos tényezőnek köszönhetően az S63845 a kísérletekben mintegy 1000-szer hatékonyabban pusztította el az MCL1-függő mielóma multiplex sejteket, mint az A-1210477.
Az S63845 molekuláris célpontjának fajlagosságát igazolandó a kutatók megvizsgálták a gyógyszerjelölt képességét arra, hogy beavatkozzon a proapoptotikus és antiapoptotikus fehérjék közötti kölcsönhatásokba. Az elvárásnak megfelelően az S63845 azt a kötőhelyet foglalta el az MCL1-en, amely a proapoptotikus fehérjék BH3-doménja számára van fenntartva, s ezzel megakadályozta az apoptózisserkentő BAK és BAX fehérjék kötődését az MCL1-hez. Ugyanakkor az S63845 nem gátolta meg a BAK és BAX fehérjéket abban, hogy BH3 doménjuk közvetítésével más antiapoptotikus családtagokhoz, például a BCL-XL-hez vagy magához a BCL-2-höz kössenek. Ezzel a kísérlettel bizonyították, hogy az S63845 valóban az MCL1-en – és csakis azon – keresztül fejti ki apoptózisserkentő hatását. Mivel ilyen mechanizmusú gyógyszer jelenleg még nincs forgalomban, a klinikai vizsgálatok sikere esetén az S63845 ún. első generációs gyógyszerként léphet a piacra.
Sikeres vizsgálatok sejtvonalakon
A továbbiakban a tudósok felmérték az S63845-kezelésre potenciálisan érzékeny daganattípusok körét. Sejttenyészetes rendszerben a 25 vizsgált mielóma multiplex sejtvonal közül 17 kimondottan fogékonynak, további 6 pedig mérsékelten fogékonynak mutatkozott a szerre, és csupán 2 sejtvonal nem reagált a kezelésre. A fogékonyak között olyan sejtvonalak is akadtak, amelyek rossz prognózisú, más gyógyszerekkel alig kezelhető daganatokból származtak. A gyógyszer fejlesztői ezért elképzelhetőnek tartják, hogy az S63845 olyan tumorokkal is sikeresen megküzd majd, amelyek a szokványos kezelésekkel szemben érzéketlenek.
A mielóma multiplex után a kutatók egy sor emberi limfóma- és leukémia-sejtvonallal folytatták a kipróbálást. A siker ebben a rendkívül diverz csoportban változó volt, de egyes specifikus daganatféleségek, például a Burkitt-limfóma és az akut mieloid leukémia esetében valamennyi tesztelt sejtvonal érzékenyen válaszolt a kezelésre. Végezetül a sejtkultúrás vizsgálatokat kiterjesztették egy nem vérképzőszervi daganatokat felsorakoztató sejtvonal-panelra, amely tüdőrák-, emlőrák- és melanóma-sejtvonalakat tartalmazott. Ezekre a sejtvonalakra az önmagában adott S63845 kevéssé hatott, mint ahogy a korszerű célzott terápiás szerek, az ún. tirozinkináz-gátlók is csak lelassítani tudták a növekedésüket, de el nem pusztították őket. Az S63845 és a tirozinkináz-gátlók együttes alkalmazása viszont már ezekben a sejtvonalakban is markáns sejtpusztulást váltott ki, amiből az valószínűsíthető, hogy a daganatok e csoportjában az új vegyület inkább kombinációs kezelések összetevőjeként kerülhet majd a klinikai gyakorlatba.
Egérben is működik
Az in vitro vizsgálatok tehát biztatóan alakultak, ám ezek eredménye még nem lett volna perdöntő: ahhoz, hogy egy onkoterápiás szer emberi kipróbálásra kerülhessen, hatékonyságát és biztonságosságát állati daganatmodelleken is bizonyítani kell. Az S63845 ebben az éles vizsgahelyzetben is remekül teljesített. A kísérleti gyógyszer mind az immunhiányos egerekbe oltott emberi mielóma multiplexszel és akut mieloid leukémiával, mind a génmódosított, de működő immunrendszerű egerekben spontán fejlődő egér-limfómával szemben erőteljes tumorölő aktivitást mutatott. Az emberi mielómával beoltott immunhiányos egerek közül 8-ból 7-ben, az akut mieloid leukémiát hordozók közül 8-ból 6-ban teljes tumormentességet sikerült elérni; hasonlóképpen a spontán limfómás egerek 70%-ában mindössze öt napnyi kezeléssel teljesen kiirtották a daganatot. E meggyőző preklinikai eredményeknek köszönhetően a humán klinikai vizsgálatok már az idei évben megkezdődhetnek.
Lényeges, hogy az alkalmazott dózissal egyik esetben sem kellett megközelíteni azt a küszöbértéket, amelynél már komoly mellékhatásokra is számítani kellett volna, így a kezelés a tumor sikeres visszaszorítása mellett az egér ép szöveteit lényegében érintetlenül hagyta. E tekintetben a spontán egérlimfóma volt az igazán kemény próbatétel – hogy miért, az némi magyarázatot igényel. A mellékhatásokért az S63845 esetében ugyanaz a mechanizmus felelős, mint magáért a hatásért: az MCL1 gátlása. Mivel az MCL1 egyes egészséges szövetekben, egyebek között a csontvelői vérképző őssejtekben is fontos szerepet játszik, funkciójának teljes blokkolása – például egérmodellekben a gén kiütésével – súlyos szövetkárosodáshoz vezethet. Ezért fontos, hogy a daganatsejtekkel szemben hatásos dózis, illetve a már az ép szöveteket is károsító dózis között minél szélesebb legyen a „terápiás ablak”. Mármost az S63845 mintegy 6-szor erősebben kötődik az emberi MCL1-hez, mint a fehérje egérbeli megfelelőjéhez, ezért az egérbe oltott emberi daganatok esetében azt mondhatnánk: nem nagy „kunszt”, hogy az S63845 csak a daganatot pusztítja, és nem okoz mellékhatást, hiszen az emberi daganatsejtekre 6-szor erősebben hat, mint az ép egérszövetekre. Azonban a szer akkor is elpusztította a daganatot, és megkímélte az ép szerveket, amikor a daganat és a szervezet többi része is „egérből volt”. Ez világosan megmutatta, hogy az S63845 szelektivitása – az eltérő kötéserősségeket is figyelembe véve – nem elsősorban az ember-egér különbségnek, hanem a daganat kontra nem daganat különbözőségének volt tulajdonítható. Ezt erősítette az a megfigyelés is, hogy az akut mieloid leukémia sejtvonalakkal szemben hatékony dózisnak mintegy 100-szorosa – 1000-szerese volt szükséges az egészséges emberi csontvelői őssejtek károsításához. Ha ez a széles terápiás ablak a klinikumban is fennmarad, az S63845 kiemelkedően kedvező mellékhatásprofilt mondhat majd magáénak.
Kiemelt közlemény a Nature-ben
Az új vegyület és a róla hírt adó Nature-cikk több más vonatkozásban is egyedülálló. Egyrészt ritkaságnak számít, hogy e nagy tekintélyű folyóirat ipari gyógyszerkutatási eredményeknek adjon helyt hasábjain. Másrészt szintén nem szokványos, és joggal ad okot büszkeségre, hogy a nemzetközileg színes – brit, francia és ausztrál kutatócsoportok tagjait is felvonultató – szerzőgárda élén magyar tudósok szerepelnek, ráadásul egy olyan intézet képviseletében, amelyről viszonylag keveset tud a közvélemény. „A Servier Kutatóintézet 2008 januárjában kezdte meg tevékenységét Budapesten, a Graphisoft Park egyik gyógyszerkutatásra tervezett épületében. A kutatói létszám folyamatosan növekedett az évek folyamán, és 2016-ra elérte az 54 főt – tudtuk meg Blaskó Gábor akadémikustól, az intézet alapító főigazgatójától. – A kutatói állományból ketten MTA doktora címmel, 27-en pedig PhD-fokozattal rendelkeznek. Az ő gyógyszerkutatói munkájukat felsőfokú végzettségű analitikusok és jelentős tapasztalattal rendelkező vegyésztechnikusok segítik. A kutatóintézetben elsősorban szerves szintetikus kémiai gyógyszerkutatói munkát végeznek. Az onkológiai és egyes metabolikus betegségek (pl. a 2-es típusú diabétesz) gyógyszereinek kutatása képezi a két főbb terápiás területet, melyen – szoros együttműködésben a francia farmakológus és biológus kutatókkal – az intézet feladata az új gyógyszerjelölt molekulák kutatása és előállítása.”
Blaskó Gábor hangsúlyozta: a Servier Kutatóintézet nemcsak külföldi partnerekkel, hanem az MTA intézményeivel, valamint a magyar kutatóegyetemekkel is szoros munkakapcsolatot ápol. „Mivel a kutatóintézet feladata új szerkezetű, kedvező biológiai tulajdonságokkal rendelkező molekulák előállítása, elsősorban az MTA szerves kémiai kutatásokkal foglalkozó intézetével, az MTA TTK Szerves Kémiai Intézetével jött létre kutatási együttműködés – ismertette a professzor –, de kollaboráció fűz minket egyebek között az Eötvös Loránd Tudományegyetem, a Budapesti Műszaki és Gazdaságtudományi Egyetem és a Debreceni Egyetem hasonló profilú tanszékeihez is. Miután különböző kutatási pályázatoknál előnyt jelent egy ipari szereplő jelenléte is a kutatási konzorciumban, az intézet jelentős pályázati partner különböző akadémiai és egyetemi kutatócsoportok számára. Ezen túlmenően alkalmazottai jelentős szerepet vállalnak az MTA Kémiai Tudományok Osztályának különböző bizottságaiban és munkabizottságaiban.” Blaskó alapítóként fontosnak tartja azt is, hogy intézete részt vállal a kutatók új nemzedékeinek kinevelésében: „A kutatóintézet minden évben lehetőséget biztosít az egyetemi hallgatóknak, hogy itt végezzék nyári termelési gyakorlatukat, és segítséget nyújtunk számukra szakdolgozatuk vagy diplomamunkájuk kidolgozásában is.”
További információ
Kotschy András
Blaskó Gábor
Servier Kutatóintézet
+36 1 881 2012 vagy +36 1 881 2013
Magyar Tudományos Akadémia Természettudományi Kutatóközpont
+36 1 382 6200




