Magyar agykutatók egy forradalmi mikroszkópos eljárással találták meg egy hazai fejlesztésű, világsikerű gyógyszer kötődését az agyban
A cariprazine a magyar gyógyszerfejlesztés utóbbi évtizedeinek legsikeresebb alkotása. A Richter Gedeon terméke olyan antipszichotikum és antidepresszáns, amelyet az amerikai gyógyszerügyi hatóság (FDA) is engedélyezett, így már egymilliárd dollár feletti forgalmat generál évente. Bár a gyógyszer remekül működik például depresszió ellen, furcsa módon biológiai hatásmechanizmusa nem teljesen ismert. Ebben lépett hatalmasat előre a Katona István (Kísérleti Orvostudományi Kutatóintézet, KOKI), illetve Keserű György Miklós (Természettudományi Kutatóközpont, TTK) által vezetett kutatócsoport. Ehhez egy olyan új, a KOKI-ban kifejlesztett mikroszkópos eljárást használtak, amellyel nanométeres pontossággal egyenként lehet látni az idegsejtekhez kötődő és világító gyógyszermolekulákat.
Katona István szerint, bár a Nature Communications folyóiratban most megjelent eredményekhez vezető kutatás öt évvel ezelőtt kezdődött,
a történet kezdetéig még korábbra, a 2010-es évek elejére kell visszamennünk. „A 2013-ban induló, Lendület-pályázat által támogatott kutatásaink fő célja az volt, hogy kidolgozzuk az akkoriban a KOKI-ba érkezett, ún. STORM szuperrezolúciós mikroszkóp alkalmazási eljárásait az agykutatásban – mondja a KOKI Molekuláris Neurobiológia Csoportját vezető kutató. – Én a pályám nagy részében elektronmikroszkópot használtam, ami fantasztikus technológia, de nagyon lassú és munkaigényes, egyszerre pedig csak egy-két fehérjét lehet vele vizsgálni. Ezért volt nagyon izgalmas számunkra, hogy
a szuperrezolúciós fluoreszcens mikroszkópokkal színesben, nagy felbontásban egyszerre sok fehérjét is láthattunk a felvételen,
és megvizsgálhattuk, hogy pontosan mi történik például egy receptorral egy adott kezelés hatására.”
A floureszcens mikroszkópia működése azon alapszik, hogy ibolyántúli fénnyel megvilágítva a különböző molekulák eltérő színű (hullámhosszú) floureszcens fényt bocsátanak ki. Ilyen floreszcens csoportok bármilyen molekulához hozzákapcsolhatók, amelyek ezáltal nyomon követhetők lesznek például
az agyszövet mikroszkópos képén. A szuperrezolúciós mikroszkópok képesek
a fehérjéket nanométeres (a milliméter egymilliomod része) pontossággal megjeleníteni, ami hatalmas lehetőségeket rejt magában a molekuláris agykutatásban.
A marihuána aggasztó hatásaitól a gyógyszermolekulák vizsgálatáig
Az előző évtized közepén Katona Istvánék a Nature Neuroscience folyóiratban közölték a tanulmányukat arról, milyen módon lehet a STORM-mikroszkópia segítségével az idegsejttípusok alkotórészein vizsgálni a fehérjéket. A STORM
a SzTochasztikus Optikai Rekonstrukciós Mikroszkóp rövidítése. A kísérletben a kannabisz pszichoaktív hatóanyagával, a THC-vel kezelték az egereket, és
a mikroszkópos képeken azt látták, hogy egy adott idegsejt felületéről
a kannabioidreceptor-fehérjék nagy része eltűnt.
„Ezen az úton indultunk tovább, és ehhez a Lendület-pályázat szenzációs segítséget nyújtott, hiszen öt év biztonságot adott, mi pedig ez idő alatt nyugodtan tudtunk dolgozni – folytatja Katona István. – Szoftvert fejlesztettünk a felvételek elemzésére, amely a Nature Protocols folyóiratban jelent meg, és olasz partnereinkkel együtt felfedeztük, hogy a THC-t kapó anyaegerek utódainak dopamintartalmú sejtjei hiperaktívak, sokkal erősebben reagálnak az ingerekre."
Ez magyarázatul szolgálhat arra, hogy a THC-fogyasztó édesanyák gyermekei miért szenvednek sokkal nagyobb valószínűséggel különböző pszichiátriai betegségekben.
E kísérletekben (a molekuláris biológiai kutatásokban elterjedt módon) antitesteket használtak a fehérjék felismerésére. Az antitestek specifikusan kötődnek az előre meghatározható fehérjékhez, így azok azonosíthatóvá válnak. Csakhogy az antitestek túlságosan nagyok, 15 nanométeresek (ami igazából nagyon kicsi, de a molekuláris neurobiológia mérettartományában
ez hatalmasnak számít). Emiatt az antitestek nehezen jutnak be az agyszövet belsejébe, nehezen találják meg a célfehérjét. Ott vannak azonban
a kismolekulájú, alig egy nanométeres gyógyszermolekulák, és az agykutatók azon kezdtek gondolkodni, hogy vajon jelölhetnék-e ezeket fluoreszcens festékkel, hiszen elképzelhető volt, hogy e gyógyszermolekulák majd jobban eloszlanak a szövetben, és hatékonyabban ismerik fel a célfehérjéket.
E fejlesztést tűzték ki célul az akkoriban indult Élvonal-pályázatban, miközben Keserű György Miklós csoportja pedig fluoreszcensen világító kismolekulák kifejlesztésére kapott támogatást a Nemzeti Agykutatási Program keretében.
A két téma tökéletesen kiegészítette egymást, így 2016-ban együttműködésbe kezdett a két kutatócsoport egymással. Először világító kannabiszmolekulát készítettek Ábrányi-Balogh Péter segítségével, amely bekötődött a kannabioidreceptorra, és a sejthártyán nanométeres pontossággal vizsgálhatóvá vált.
Ez valóságos mérföldkő a gyógyszerhatástani vizsgálatokban.
„Korábban úgy mérték a gyógyszerek kötődését, hogy kiemelték a kérdéses szövetet az egerek agyából, majd feltrancsírozták, és csak általánosságban tudták megmérni azt, hogy a gyógyszerből mennyi kötődött az idegsejtekhez – mondja Katona István. – Csakhogy ez a felbontás messze nem elég
a gyógyszerek valós hatásmechanizmusainak vizsgálatához. Ma már tudjuk, hogy nagyjából ezer különböző, funkciója alapján elkülöníthető agyterület létezik, minden agyterületen van százféle idegsejttípus, amelyek felszíni fehérjéi is rendkívül bonyolultak. Nem elegendő tehát a homogén összedarált szövetet mérni, hiszen előfordulhat, hogy az egyik sejten több van a kötődő fehérjéből, mint a másikon. Vagyis nagyon fontos, hogy egy adott sejtre, sőt
a sejt különböző részeire (például az axonra vagy a dendritre, vagyis a hosszú, jelküldő és a rövid, jelfogadó nyúlványaira) specifikusan tudjunk molekuláris méréseket végezni.”
 A cikk első szerzője, Prokop Susanne és Katona István. Évtizedes szimbolikus hagyomány
A cikk első szerzője, Prokop Susanne és Katona István. Évtizedes szimbolikus hagyomány a kutatócsoportban, hogy az első és az utolsó szerző közösen nyomja meg az egeret, amikor beküldik a folyóiratnak a publikációt Forrás: KOKI/Katona István
A fluoreszcensen jelölt gyógyszermolekulák révén tehát olyan vizsgálati módszert fejlesztettek ki, amely új alapokra helyezte az idegsejtek receptorainak vizsgálatát. Később egy holland csoporttal közösen egy enzim vizsgálatára készítettek világító gátlómolekulát, aztán jött egy ioncsatorna, amelyhez ugyancsak remekül kötődött a fluoreszcens kismolekula, vagyis az „üzlet beindult”. „Ez nagyon fellelkesített, hiszen bebizonyosodott, hogy három nagy fehérjecsalád (receptor, enzim, ioncsatorna) egy-egy képviselőjéhez is sikerült olyan világító molekulákat kapcsolnunk, amelyek segítségével egyenként le tudtuk számolni, hogy az idegsejt felületén hány darab van belőle – folytatja az agykutató. – Ekkor elérkezett a legfontosabb lépés: megpróbáltuk egy tényleges, a mindennapi gyógyászatban használt molekulára is alkalmazni az alapötletet, amit FarmacoSTORM-nak neveztünk el.”
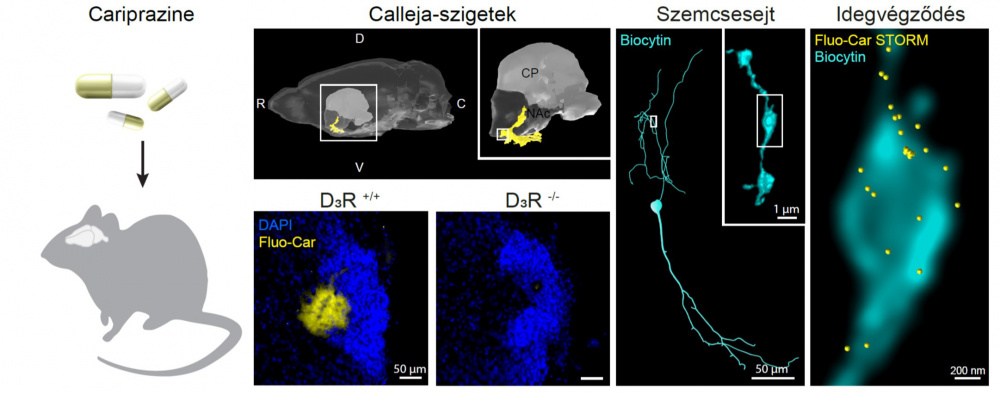
A kutatók számára magától értetődő volt, hogy az első megvizsgált valódi gyógyszermolekulának a cariprazine-t választják, hiszen – Katona István szavaival – „ez egy fantasztikus gyógyszer, még a Richter Gedeon kémikusaként Keserű Györgynek fontos szerepe volt a kifejlesztésében, és elképesztő sikereket ér el a nyugati piacokon”. Ugyanakkor meglepően keveset tudunk a hatékonyságát megalapozó neurobiológiai mechanizmusról és arról, hogy ez miben különbözik a korábbi antipszichotikumoktól és antidepresszánsoktól. Nem volt ismert például az sem, hogy az agy mely részén fejti ki a hatását. Aztán jött az áttörés. „Számomra ez a kutatás az egyik legfantasztikusabb dolog, amihez valaha hozzájárulhattam” – vallja be Katona István.
 Forrás: KOKI/Katona István
Forrás: KOKI/Katona IstvánAz első kísérletekben, amikor az egér agyában azt a helyet keresték, ahová
a fluoreszcens festékkel jelölt cariprazine beköt, szinte semmit sem lehetett látni. Azután viszont a tanulmány első szerzője, Prokop Susanne észrevette, hogy az agy alsó felszínén van egy kis sárgán világító folt. A szükséges kontrollvizsgálatok után kiderült, hogy a cariprazine valóban ide, az úgynevezett Calleja-szigetek nevű agyterületre kötődik. Nos, nem ez az agy leginkább kutatott régiója, pedig már több mint száz éve leírták. A cariprazine-ról ismert, hogy több receptorhoz is kötődhet, de legjobban a 3-as dopaminreceptort kedveli. Amikor pedig olyan egereket kezeltek cariprazine-nal, amelyekből kiütötték a 3-as dopaminreceptor génjét, akkor eltűnt
a Calleja-szigetekről a gyógyszer kötődése. Ezzel bebizonyították, hogy
a cariprazine valóban a terület dopaminreceptoraihoz köt. Később Barti Benjámin kísérleteinek köszönhetően az is kiderült, hogy az ún. szemcsesejtek axonjain lévő receptorokhoz kötődik.
„E felfedezés azért nagyon izgalmas, mert itt van egy gyógyszer, amit immár több millió beteg szed, ugyanakkor nem értjük pontosan, hogy miért működik másként, mint a korábbi gyógyszerek. Most pedig kiderült, hogy egy olyan agyterület sejtjein fejti ki a hatását, amellyel eddig szinte senki nem foglalkozott – érvel Katona István. – Eddig évi két-három publikáció jelent meg róla, viszont az a tény, hogy ez a hatékony gyógyszer ilyen erősen kötődik
a sejtjeihez, arra utal, hogy ez a terület nagyon fontossá fog válni számos pszichikai betegség mechanizmusának kutatásában.”
A Calleja-szigetekről szinte semmit sem tudunk, nem tudjuk például, hogy
az itteni sejtek mely más agyterületek idegsejtjeivel állnak kapcsolatban.
A kevés kutatás eredményei alapján feltételezik, hogy az addikciókban, illetve a különböző, dopaminpálya által szabályozott agyműködésekben, például
a motivációban lehet szerepe, de erre közvetlen kísérleti bizonyítékok nincsenek. Minthogy a cariprazine e rendszerek működési zavarait gyógyítja,
a magyar kutatócsoportok most a Calleja-szigetek sejtjeinek részletes vizsgálata felé fordulnak, hiszen nagyon valószínű, hogy e sejteknek számos idegrendszeri betegségben fontos szerepük lehet.
A kutatásban tehát a kutatók összekapcsolták a gyógyszertani, farmakológiai módszereket a szuperrezolúciós mikroszkóp anatómiai vizsgálataival. Elméletben mostantól nincs akadálya, hogy ezzel az eljárással bármely más gyógyszermolekula kötődését megvizsgálják, bármilyen sejttípuson, nemcsak az idegrendszerben, hanem akár a vesében és a májban is.
Az eredeti, szabad hozzáférésű tanulmány itt olvasható. A kutatócsoport honlapja: katonalab.hu.







